镁的化学活性很强,在空气中易氧化,在原镁生产、合金熔炼及合金化过程中易产生大量的夹杂物并带入大量的气体,因此熔炼镁合金时常采用专门的熔剂对镁液进行精炼,去除镁液中的气体、氧化夹杂物以及一些有害合金元素。镁合金熔剂的主要成分是碱金属或碱土金属的氯化物及氟化物的混合物。
1.对除夹杂物熔剂性能的要求[22]
(1)熔点 应低于金属液的熔点,这样可使熔剂在整个合金熔炼过程中保持液体状态,在金属熔炼过程中形成完整严密的覆盖层或精炼时能很好地吸附合金液中的夹杂物及易于从金属液中分离。
(2)密度 熔剂和金属液应有较大的密度差,即熔剂的密度或者大于金属液的密度或者小于金属液的密度,以防止熔剂混杂在金属液中成为熔剂夹杂物。
(3)粘度 从覆盖的角度看,要求熔剂的粘度小些,以便在金属液面上容易铺开;从浇注操作的角度分析,则要求熔剂的粘度应大些,便于将熔剂和金属液分开。
(4)造渣性 熔剂本身不应带有对金属液质量有害的杂质及夹杂物,对于精炼熔剂来说,应有较强的俘获金属液中气体夹杂物并迅速沉降的能力。
(5)化学稳定性 熔剂不与镁合金、坩埚壁、炉衬及炉气发生化学反应,熔剂本身不挥发、不分解。
(6)无公害 熔剂本身对人体无毒,不会燃烧,便于运输储存,使用中产生的有害气体要少,残渣便于处理。
2.熔剂的主要组元
目前国内常使用的熔剂是商品化的RJ系列熔剂,见表2-12。国外主要镁合金熔剂的成分、性能及用途见表2-13。
表2-12 镁合金用熔剂的化学成分[23]
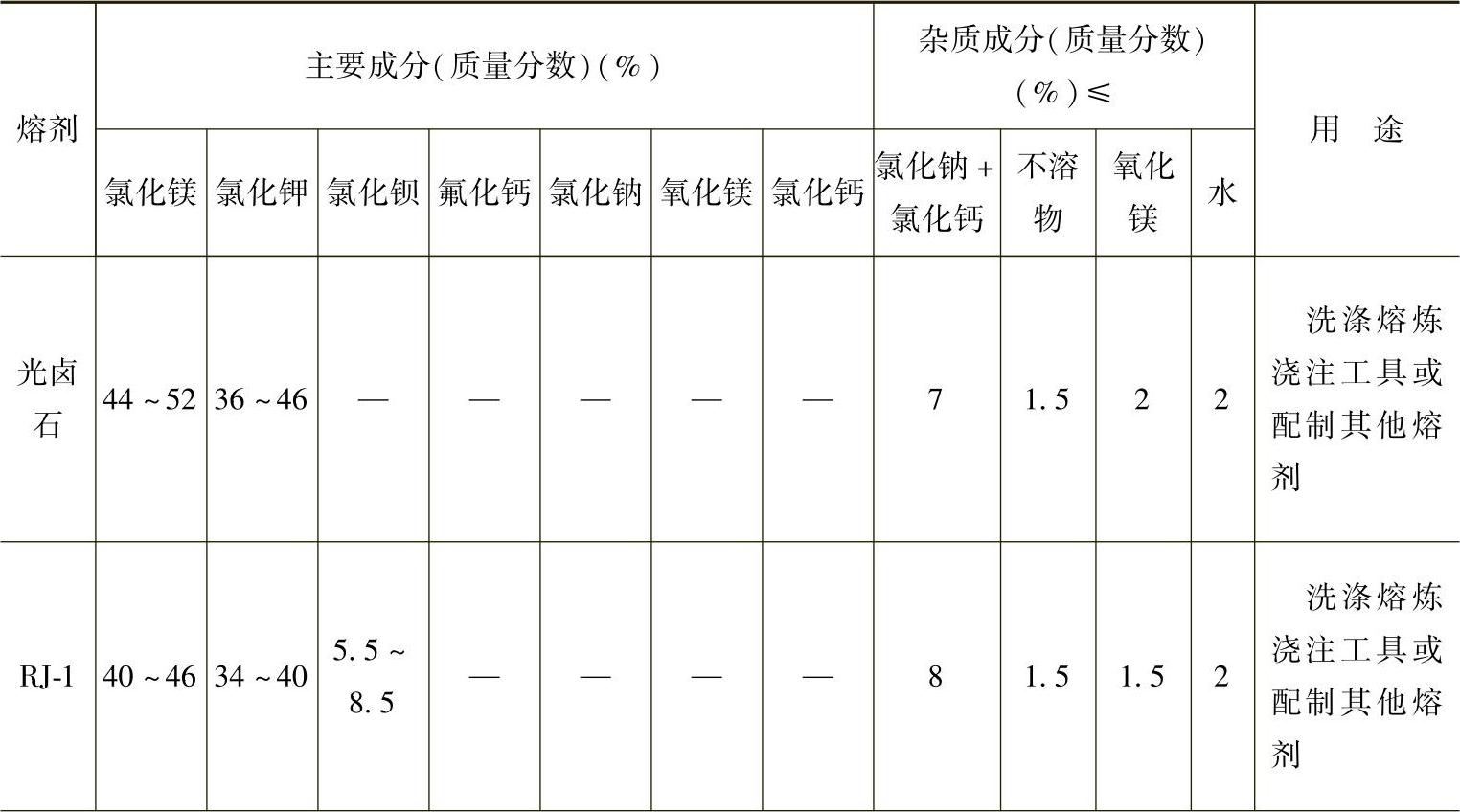
(续)
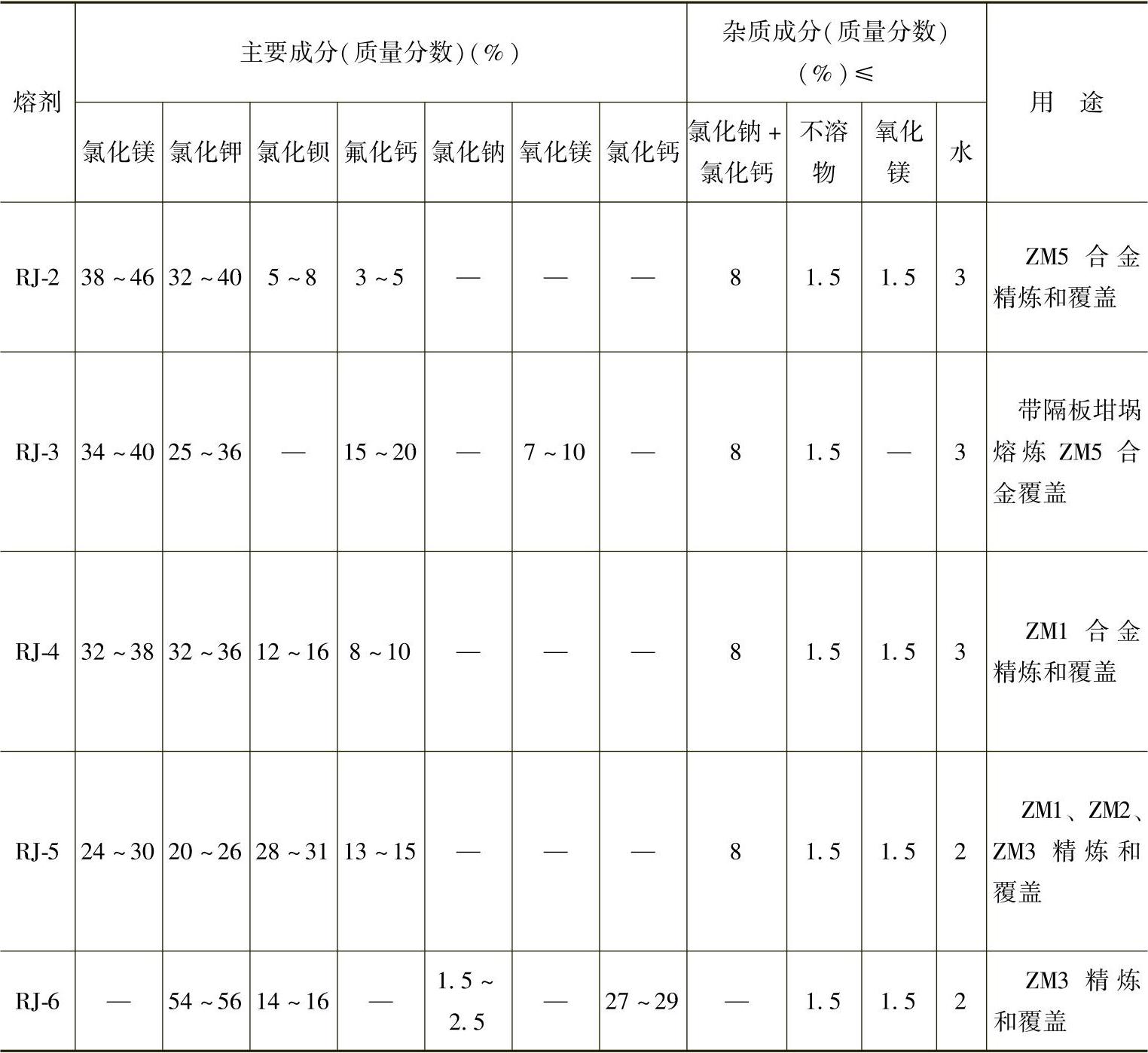
注:杂质成分的数值为所允许的质量分数上限。
表2-13 国外镁合金熔剂的成分、性能及用途
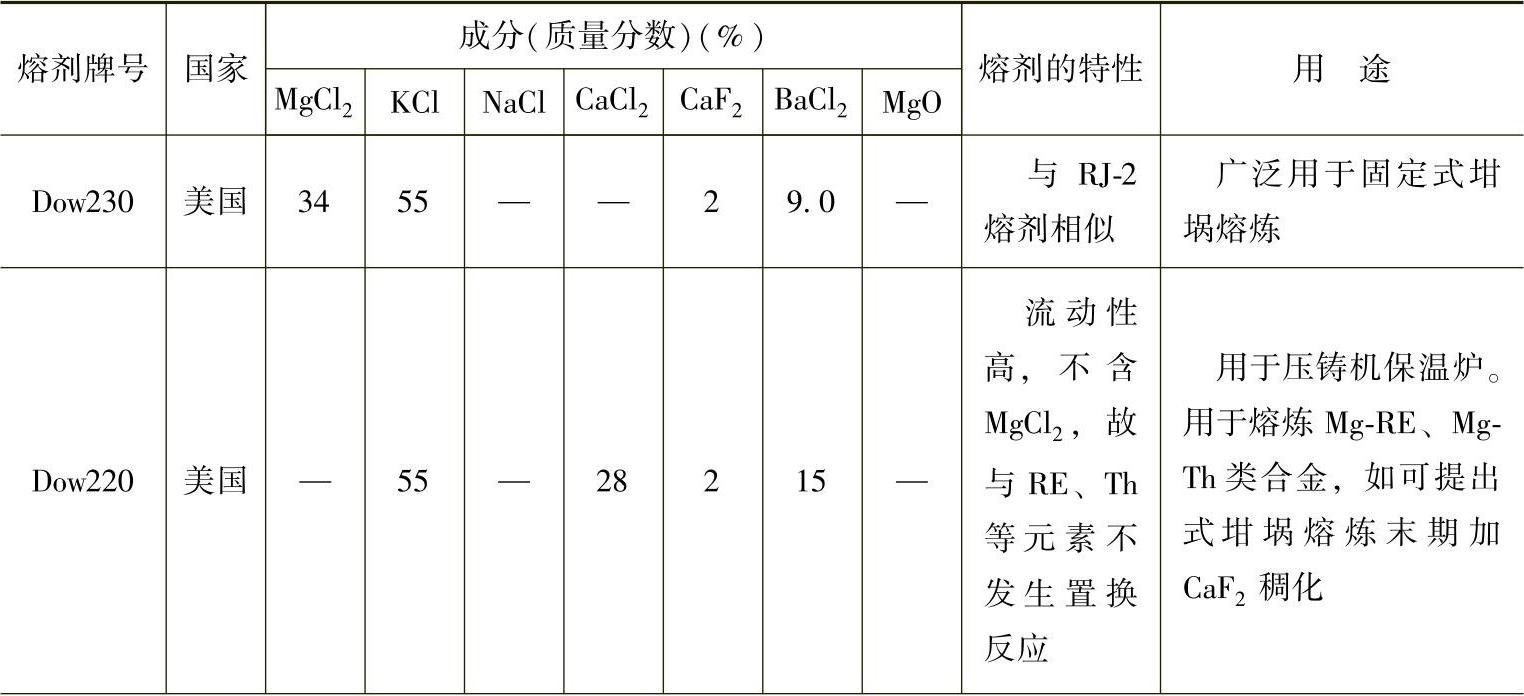
(续)
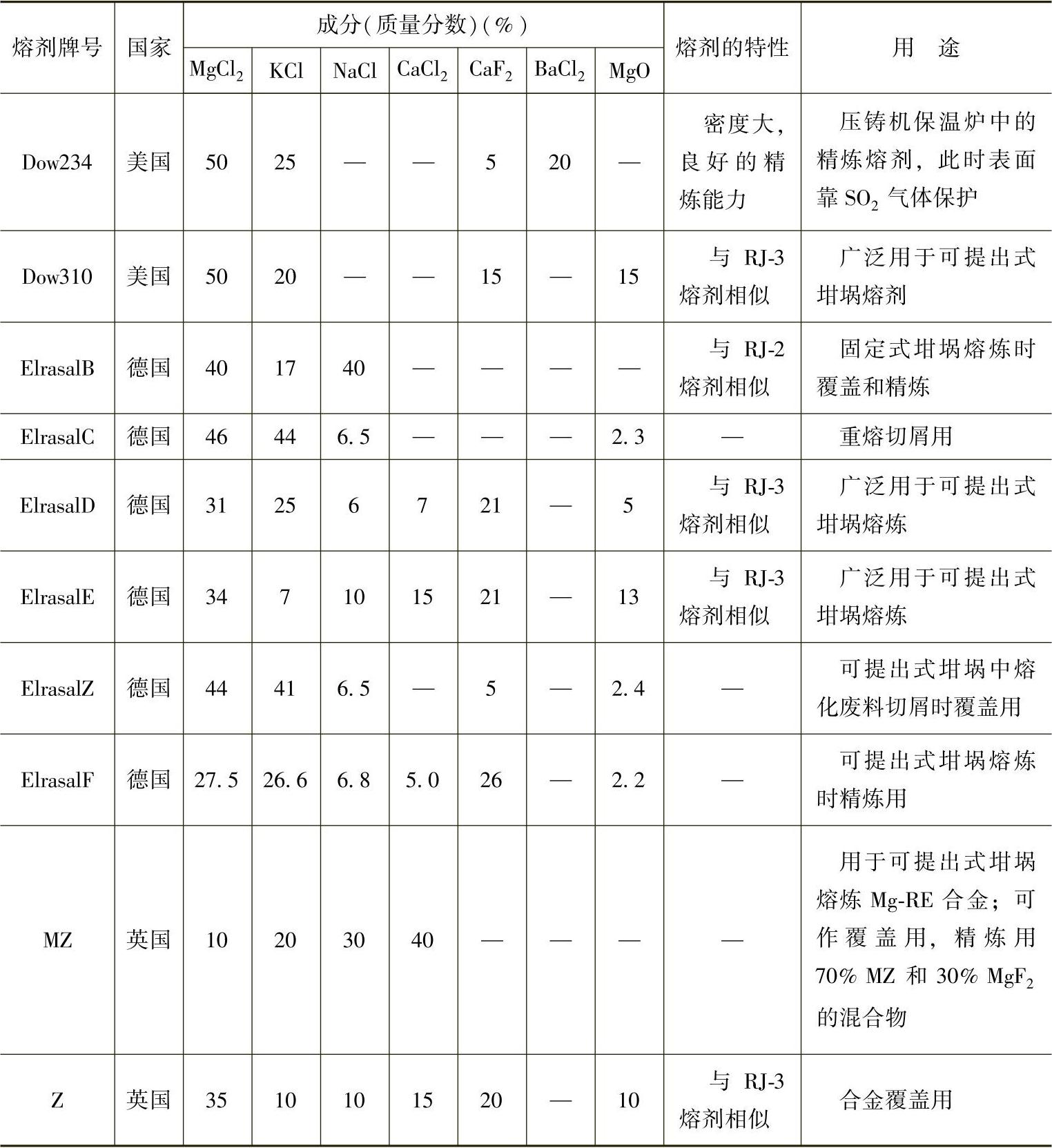
熔剂的主要组分均为氯盐和氟盐,各主要组成物在熔剂中的作用如下:
1)MgCl2:通常含有六个结晶水MgCl6·6H2O,加热时会失去两个结晶水,成MgCl2·4H2O。这时MgCl2发生水解生成MgO及HCl,所以MgCl2的脱水应在特殊的装置中进行。MgCl2是镁合金熔剂的基本组元,高温下MgCl2一部分与大气中O2及H2O等反应,在镁液表面形成保护气氛HCl及H2,阻缓镁液的氧化。液态MgCl2对镁液中的MgO、Mg3N2等夹杂物具有良好的润湿能力,并能与MgO形成MgCl2·5MgO复合化合物,因而具有较强的去除氧化夹杂物的能力。
2)KCl:熔剂的基本组元。KCl表面张力、粘度均较小,能降低熔剂的表面张力和粘度,改善熔剂的铺开性能,使熔剂能均匀地覆盖在镁合金液体表面。
3)NaCl:熔剂的基本组元。NaCl与MgCl2、KCl构成MgCl2-KCl- NaCl三元系。它的存在使熔剂的密度增加,并可用来调整熔点。图2-10所示为MgCl2-KCl-NaCl三元系熔度图[24],这个体系中有三个共晶点,七个初晶区,其共晶点、共晶成分和固相组成见表2-14。从熔度图可以看出,该体系中有一系列状态点,其初晶温度均低于镁合金的熔点,这样在镁合金熔化时,能有效地起到保护作用,所以选择MgCl2、NaCl、KCl为覆盖剂、精炼剂的基本组元。
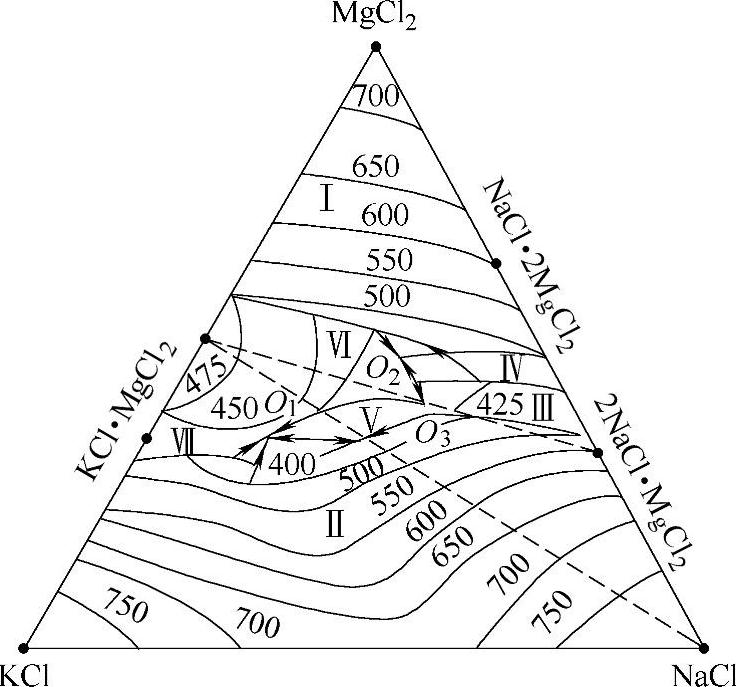
图2-10 MgCl2-KCl-NaCl三元系熔度图
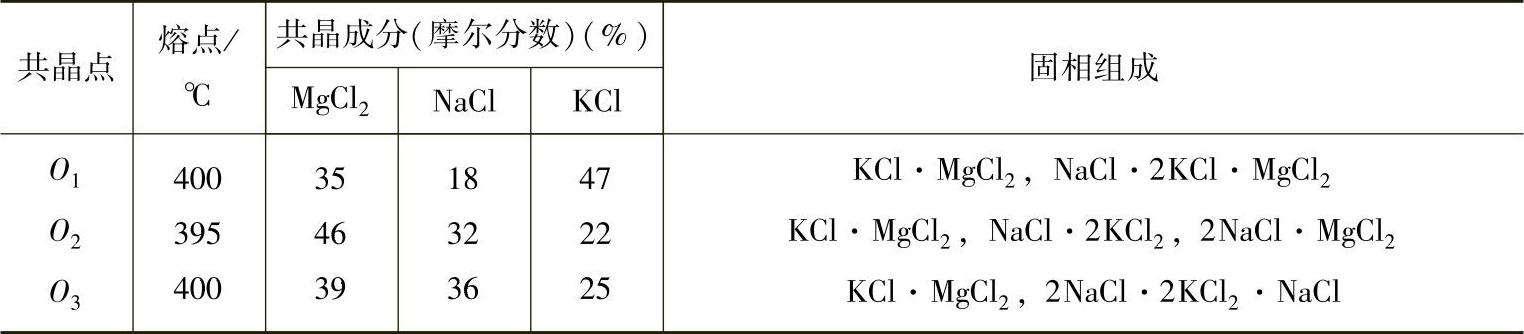
表2-14 MgCl2-KCl-NaCl三元系的共晶点、共晶成分和固相组成
4)CaF2:可提高熔剂的粘度和精炼性能。CaF2在MgCl2-KCl-NaCl三元系中有一定的溶解度,超过此溶解度时,液态的混合盐中出现了未溶解的Ca初质点,大大提高了混合盐的粘度。另外,CaF2+MgCl2=MgF2+CaCl2,生成的MgF2在氯盐中溶解度很小,且其溶解度不随温度变化,MgF2还有与MgO化合而造渣的能力。CaF2提高熔渣与镁合金液的分离性能,具有良好的聚渣作用,覆盖剂中加入CaF2可以很方便地去除表面熔渣。
5)MgO:用作熔剂的“稠化剂”,提高熔剂的粘度。
6)BaCl2:BaCl2具有较大的密度,室温下为3.87g/cm3,作为“加重剂”加入。BaCl2主要提高熔剂的密度,使熔剂与镁合金液分离,提高精炼效果。但是,对于覆盖用的保护熔剂,BaCl2的加入是无益的。加入BaCl2后熔剂的密度和熔点都迅速提高,当熔剂密度超过镁的密度时,熔剂会沉于镁液之中,降低熔剂的保护性能。
7)发泡剂:特殊的无机化合物,加入覆盖剂中,在镁合金熔炼温度下,持续地释放出对镁液具有保护作用的气体,使覆盖剂成泡沫状,不易下沉,减少了覆盖剂的使用量,同时释放出的保护气体稀释了HCl等有害气体,显著减少了使用过程中有害气体的排放,达到无公害的目的。当这种发泡剂加入精炼剂时,它使精炼剂发泡,极大地增大了比表面积,从而提高了熔剂吸附氧化夹杂物的能力。另外,它所释放出的气体,又对镁液进行物理除气,因而强化了熔剂的精炼能力。
3.熔剂的物理化学性质
熔剂的物理化学性质随许多因素的变化而变化,如温度、熔盐组分、杂质、添加剂量等。一些常见熔剂主要组成物的物理化学性质见表2-15。
表2-15 熔剂主要组成物的物理化学性质
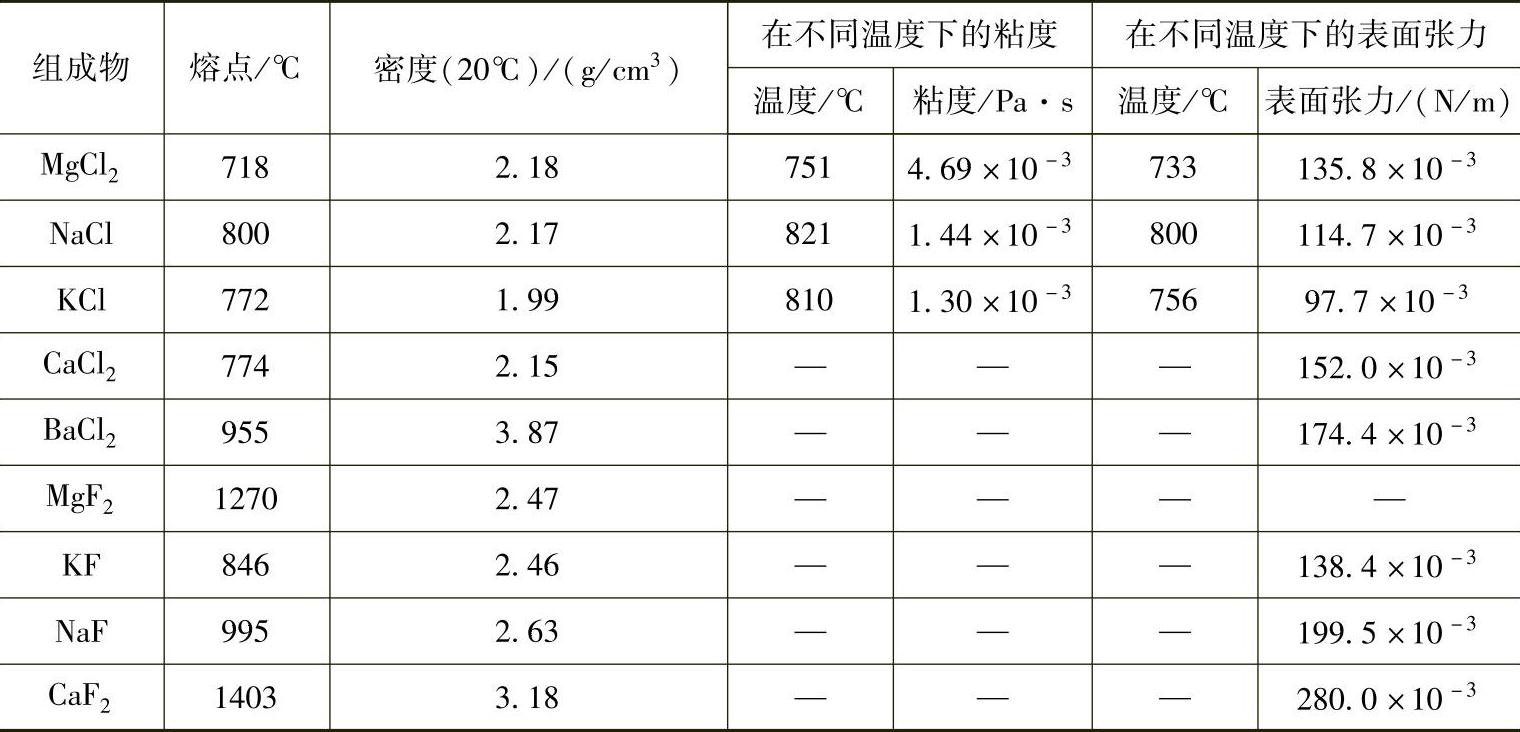
表2-15的数值表明,某元素氯化盐的熔点与表面张力均小于该元素氟化盐。BaCl2在氯化盐中有较大的密度,KCl的粘度和表面张力都较小。研究表明,纯盐的密度都随温度呈直线变化,可以用下式表示:(https://www.xing528.com)

式中α——与纯盐性质有关的系数,根据文献资料取值为:
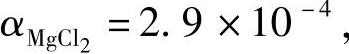
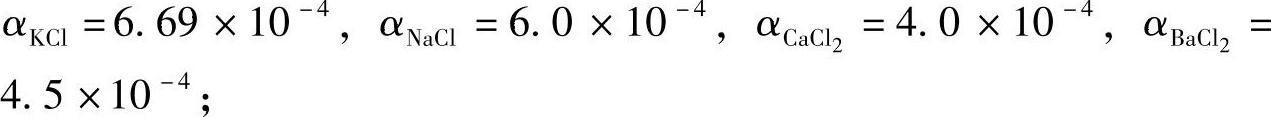
ρT——纯盐在温度T(K)时的密度(g/cm3);
ρ熔——纯盐在熔点时的密度(g/cm3);
T0——室温(K)。
熔盐粘度η与温度T(K)的关系可用下式表示:
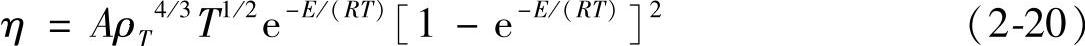
式中A——与温度T有关的常数[cm2/(s·℃)];
E——液体中质点间的键能(J/mol)。
单体熔盐的表面张力σ(N/m)与温度T的关系可用下式计算:
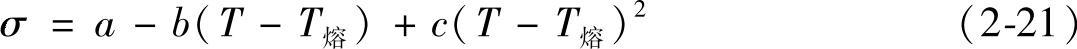
式中a、b、c——分别为不同熔盐的系数常数;
T熔——盐的熔点(K);
MgCl2、KCl、BaCl2等系数常数可从手册中查出。
熔盐的精炼性,是指氯化物的润湿吸附性,从浸渍氧化镁实验和被氧化镁吸收的含量看,其润湿性能力为KCl>NaCl>MgCl2>CaCl2>BaCl2。参考文献[25]也表明,MgCl2能有选择地和MgO发生化学吸附,因此从熔剂单体的物理化学性质来看,精炼剂的主体系应由MgCl2-KCl或MgCl2-KCl-NaCl组成,MgCl2- KCl或MgCl2-KCl-NaCl混合熔盐体系的物理化学性质,能满足精炼熔剂的条件。要改变精炼各过程中的物理化学性质,BaCl2是较好的加重剂,氟化盐是较好的非表面活性物质,添加于熔剂中,用以改善熔渣与镁合金液的分离性和增大熔剂表面张力。
在精炼过程中通常还添加CaF2。CaF2在氯化盐熔体中的行为可归纳为以下几种情况:
1)CaF2在氯化盐熔体温度下(800℃),大部分以悬浮态存在,溶解度很小。
2)添加CaF2能较大地提高氯化盐熔体和镁液间的界面张力,1%~2%(质量分数)CaF2能使熔体界面张力提高5%~8%。
3)添加CaF2能使熔体密度和粘度增加1%~5%,密度和粘度的变化值按添加量呈线性增加,但总的影响较小。
4)添加CaF2能增强熔体对氧化物杂质的吸附润湿性,改善镁的汇聚,并能和部分氧化物发生化学反应。
4.杂质的去除机理
镁熔体中的非金属杂质有MgO、CaO、SiO2、Mg3N2、2CaO·SO2、Al2O3等,Mg3N2放在空气中吸水,很快变成Mg(OH)2,Mg(OH)2在熔体中也以MgO形式存在。金属杂质K、Na、Fe、Zn、Mn、Cu、Al、Ni等部分以合金形式存在于镁中,它们对熔体的物理化学性质影响小,因此引起物理化学性质发生变化的主要是非金属氧化物杂质,其行为归纳为:
1)大部分氧化物能被KCl、NaCl润湿,部分氧化物(MgO和CaO)能和MgCl2形成稳定或不稳定的配合物:
MgO+MgCl2=MgCl2·MgO (2-22)
CaO+MgCl2=MgCl2·CaO (2-23)
5MgO+MgCl2=5MgO·MgCl2 (2-24)
熔剂中含有氟化物会降低熔剂和夹杂物之间的界面张力,也就是降低了亥姆霍兹自由能变化,从而可以提高净化效果。
2)杂质的溶入随着熔盐的汇聚和沉积,能使熔盐的密度增大、凝固点提高、粘度变大。
3)大部分氧化物杂质被熔盐浸渍后,在熔体中表现为表面活性物质,降低熔盐的表面张力。
4)氧化物都能使镁和熔剂的分散体系稳定,不利于镁的汇聚。
由此可见,氧化物杂质能被熔盐体系用物理或化学吸附的方式而去除,对于金属杂质K、Na,一般都能在熔体中发生下列置换反应而被除去:
2K+MgCl2=2KCl+Mg (2-25)
2Na+MgCl2=2NaCl+Mg (2-26)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




