1.纯镁的物理、化学性质
镁的晶体结构和原子核外层的电子构造决定了镁及其合金具有特殊的物理化学性质。
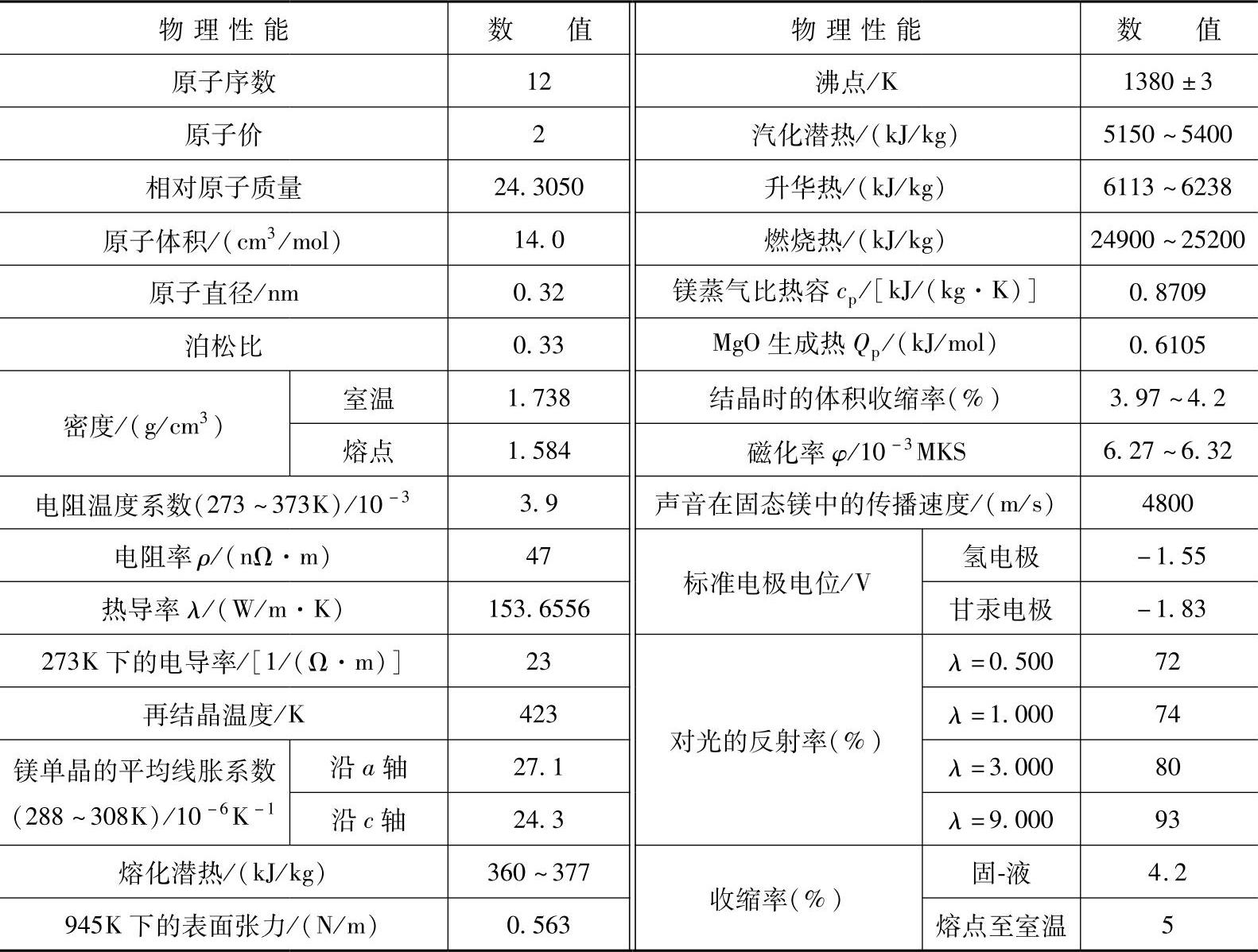
(1)纯镁的物理性质 表1-11列出了镁常见的物理性质。外层为3s2的自由价电子结构使镁不具有任何共价键的特性,导致了镁具有最低的平均价电子结合能和金属中最弱的电子间结合力。镁的这种电子结构使得镁具有较低的弹性模量E=45GPa。与镁的原子核外层电子构造形成对比,纯铝原子核外层附加的3p1共价键导致其具有更高的弹性模量E=71GPa。
表1-11 镁的物理性质
(2)纯镁的化学性质
1)镁与氧的化学反应。镁是极活跃的金属元素,在固态时就可以氧化。在大气下熔炼时,镁熔体与空气中的氧直接接触,将产生强烈的氧化作用,生成氧化镁,其反应式为
2Mg+O2=2MgO(1-1)
镁一经氧化,就变成氧化物,通常称为氧化烧损。镁与氧的化学亲和力很大,而且生成的氧化膜是疏松的(致密度系数α=0.79)。虽然在较低温度下镁的氧化速度不大但当温度超过熔点,镁处于液态时,其氧化速度大大加快,镁液遇氧时即发生氧化而燃烧,放出大量的热,而生成的MgO层绝热性又很好,使反应生成的热量不能很好地散出去,因而提高了反应界面的温度,温度的提高又反过来加速了镁的氧化,使燃烧加剧。如此循环下去,将使反应界面的温度越来越高,最高可达2850℃,此时已引起镁的大量汽化,使燃烧大大加剧,引起爆炸。
2)镁与氢的化学作用。镁与氢不起化学反应,而是以离子状态存在于晶体点阵的间隙内,形成间隙式固溶体。但它与镁合金中某些活性强的元素能形成化合物,如BeH2、TiH2、CaH3、ZrH2等。
镁与氢的作用分为以下几个过程:
①吸附过程。氢分子在金属表面聚集,气态分子以极小的作用力完成其物理吸附而化学吸附是在更高的温度下进行的。
②扩散过程。扩散是气体原子进入金属内部的一个基本过程,吸附是扩散的前提向金属内部扩散的气体中,只有那些具有化学吸附能力的气体才能溶解于金属中。氢在金属中的扩散速度比其他气体快得多,因为氢是以原子和离子的形式进行扩散的,它的原子半径小于金属的晶格常数。氢在镁合金熔体中的扩散速度与温度、压力、熔体表面状态等有关。
③溶解。氢是简单的双原子气体,原子半径很小,故易溶于金属中。在镁合金中的溶解也是依着吸附→扩散→溶解过程进行的,即H2→2H→2[H]。
3)镁与水蒸气的反应。镁无论是固态还是液态均能与水发生反应,其反应方程式为
Mg+H2O=MgO+H2↑+Q(1-2)
Mg+2H2O=Mg(OH)2+H2↑+Q(1-3)式中 Q———热量。
室温下,反应速度缓慢,随着温度升高,反应速度加快,并且Mg(OH)2会分解为H2O及MgO,在高温时只生成MgO。在其他条件相同时,镁与水汽间的反应将较Mg-O间的反应更为激烈。
4)镁与氮的作用。镁与氮的反应方程式为
3Mg+N2=Mg3 N2(1-4)
上述反应在室温下速度极慢,当镁处于液态时,反应速率加快,生成多孔性Mg3 N2膜,该膜不能阻止反应的继续进行,不能防止镁的进一步蒸发,因此氮气不能阻止镁熔体的氧化和燃烧。Mg与N2反应的激烈程度比Mg-O、Mg-H2O间的反应要弱得多。
5)镁与CO2、CO间的反应。镁与CO2、CO反应生成(Mg2C+MgO)复合物。在低温下,反应进行十分缓慢。因此可以认为,这两种气体对固态镁是惰性气体。但是在高温下,镁与CO2、CO气体间的反应将会加速。不过,其程度远较Mg-H2O、Mg-O反应小。反应生成的表面膜有一定的防护作用。
6)镁与硫及SO2的反应。
①镁与硫的作用。硫与镁接触时,一方面受热蒸发(硫的沸点为444.6℃),形成SO2保护性气体,另一方面硫与镁熔体反应,在熔体表面形成较致密的MgS膜(致密度系数α=0.95),减缓了镁熔体的氧化。(https://www.xing528.com)
②镁与SO2的作用。反应方程式为
3Mg+SO2=2MgO+MgS(1-5)
生成的2MgO+MgS复合表面膜近似致密,因此SO2对镁熔体有一定的防护作用。
7)镁的其他化学反应。此外,镁与一些碳氢化合物、氯气和盐熔剂均会发生化学反应。这些反应在镁的覆盖和精炼中起着重要作用。
2.镁合金的物理、化学性质
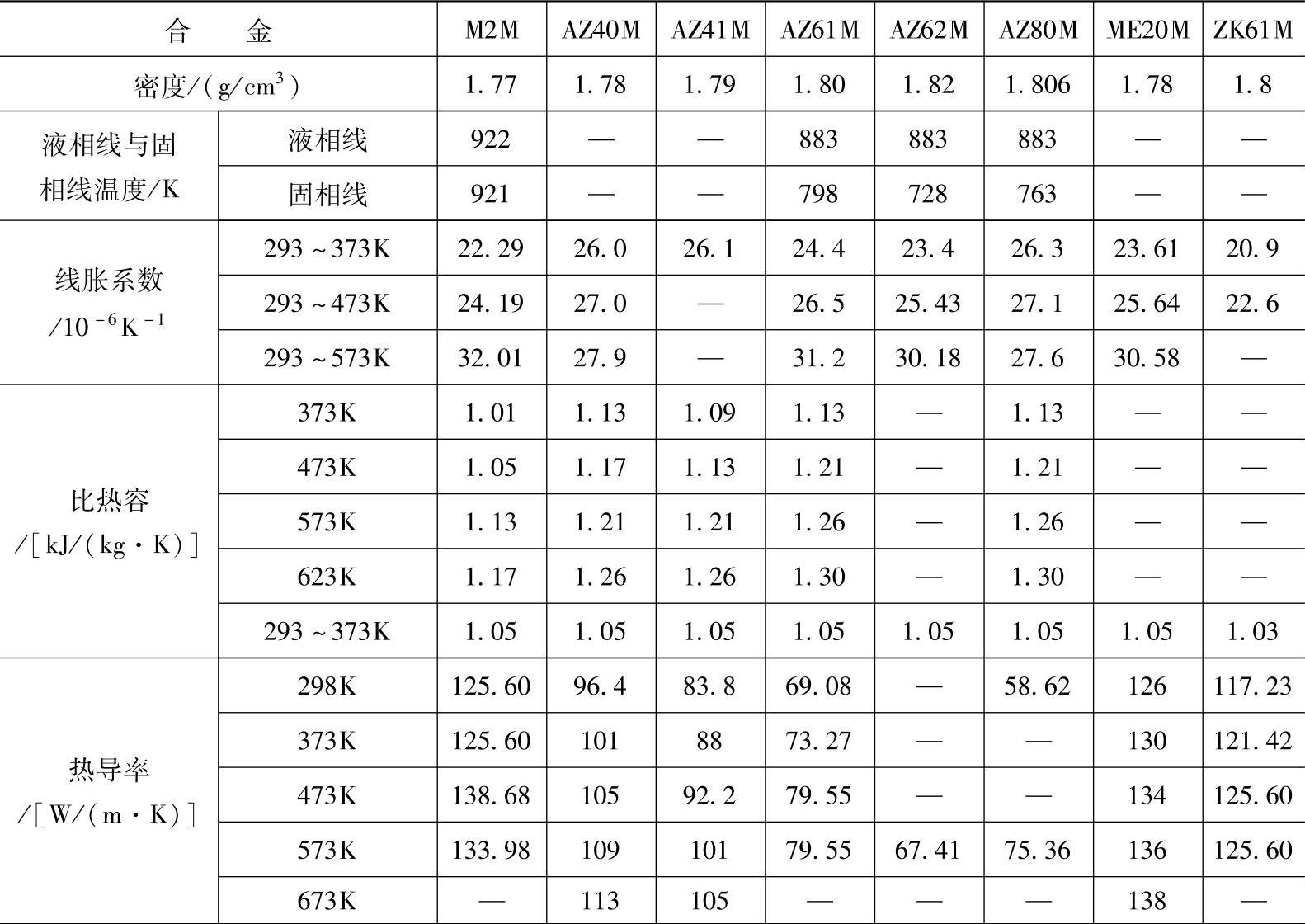
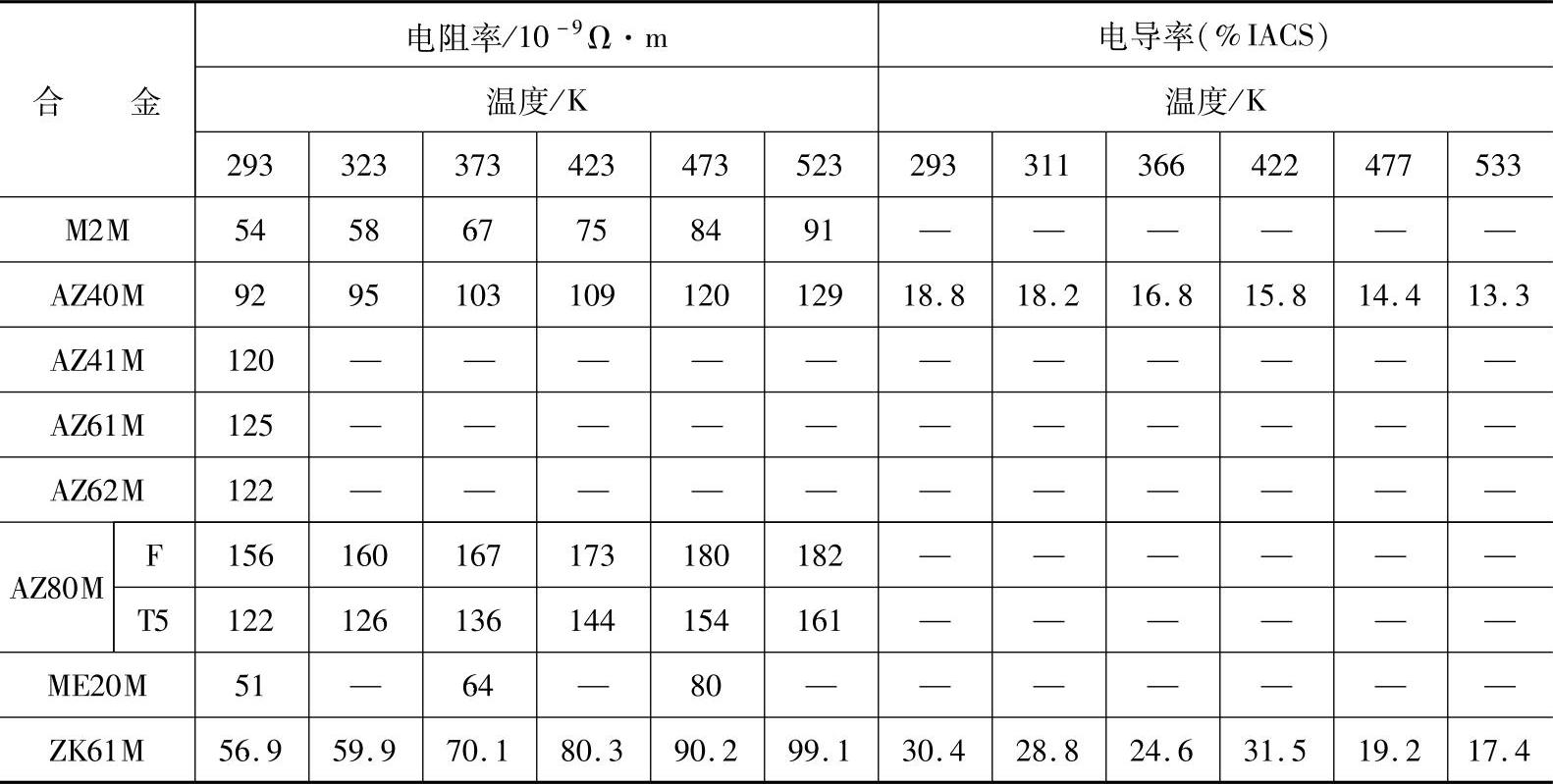
(1)镁合金的物理性质 镁合金的物理性质主要取决于合金成分和使用环境,表1-12列出了国内一些常用镁合金的物理性质参数。表1-13列出了部分镁合金的电性质参数。
表1-12 常用镁合金的物理性质参数
(续
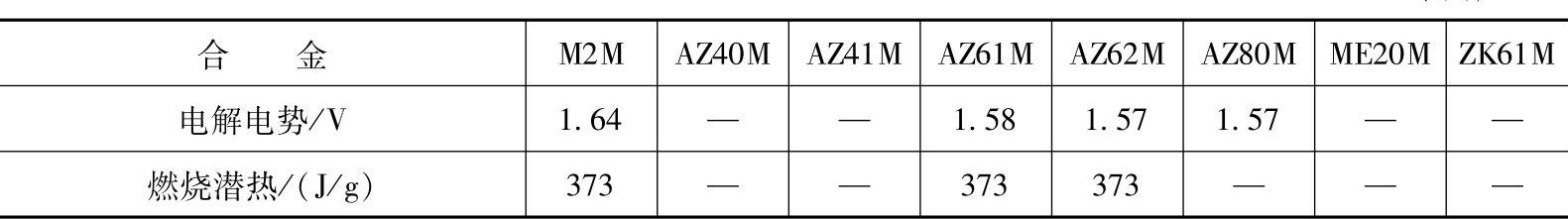
注:1.密度指293K时的值。
2.比热容指298K时的值。
3.电解电势对应饱和的甘汞电极
表1-13 部分镁合金的电性质参数
(2)镁合金的化学性质 镁合金的抗氧化性和耐蚀性随合金化学成分的不同而存在一定差异。高纯镁具有较好的耐蚀性,但合金中的Fe、Cu、Ni等杂质元素会降低镁的耐蚀性,对其含量应严格控制。Mn、RE等元素能改善镁合金的耐蚀性,通过合理控制Fe、Mn含量比,可使镁合金耐蚀性得到明显提高。尽管如此,由于镁合金表面生成的氧化膜不致密,因此未经表面处理的镁合金抗氧化能力较差,通常需要进行表面钝化或涂漆处理。此外,AZ40M、AZ41M、MB25等合金有一定的应力腐蚀倾向,而ME20M、MB22合金则无应力腐蚀倾向,ZK61M合金的应力腐蚀倾向也不大。表1-14和表1-15分别给出了镁合金MB22和MB25合金的拉伸应力腐蚀试验结果。尽管AZ40M、ME20M等合金具有良好的耐蚀性,但是在工业、海洋和潮湿环境下,仍容易被腐蚀,因此也需要进行表面抗氧化处理。
表1-14 MB22镁合金拉伸应力腐蚀参数
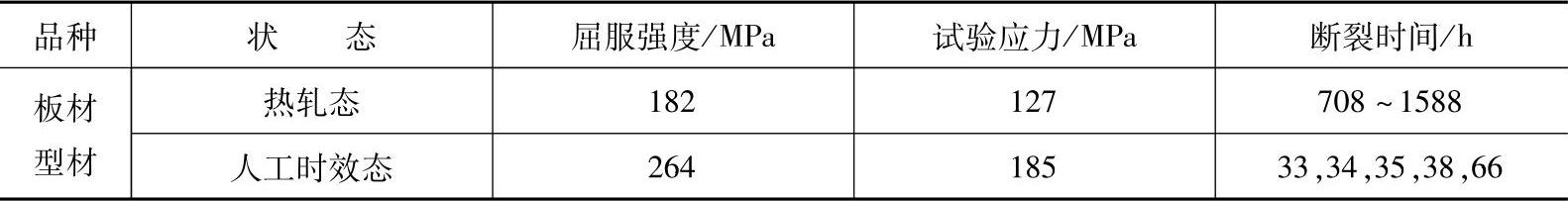
注:腐蚀介质为0.5%(质量分数)氯化钠溶液,温度为308±1K,试验应力为0.7Rp0.2
表1-15 MB25镁合金应力腐蚀试验结果
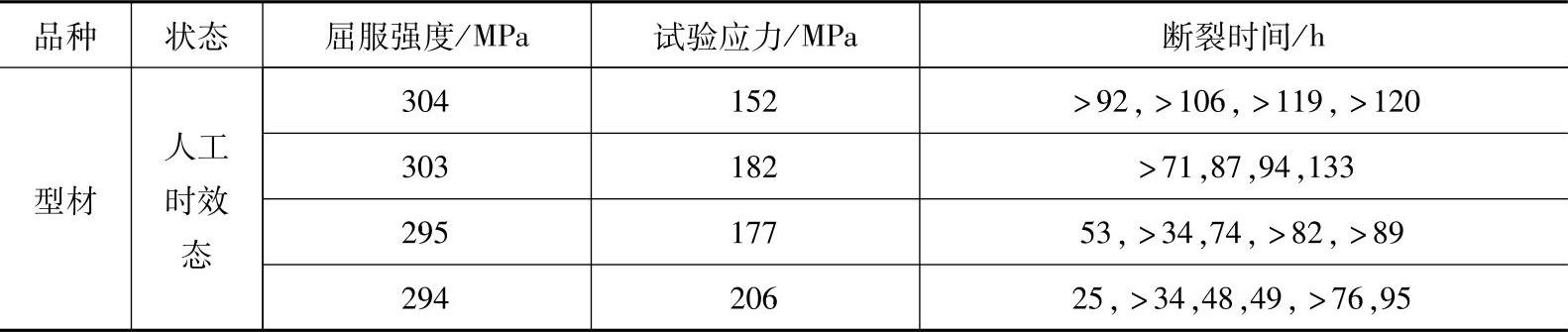
注:腐蚀介质为0.5%(质量分数)氯化钠溶液,参照GB/T 5153—2003方法
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




