晶体化学是研究晶体的化学成分与晶体结构构造之间的关系,从而阐明晶体的形态、性质及成因的科学。晶体化学对晶体的合成仿制有着重要的意义,它是研究合成宝石的理论基础。
化学成分和结构是晶体的形态、性质的决定因素。晶体的形态、性质是其化学成分和内部结构的外在反映。
一、决定晶体结构的基本因素
(一)原子半径、离子半径和配位数
原子或离子在其原子核的外围都有运动着的电子,它在空间形成一个通常认为是球形的较稳定的电磁场。这种球体的半径则分别称为原子半径或离子半径。
在晶体结构中原子或离子间距,可看做是相邻两个原子或离子有效半径之和,原子共价半径、金属半径、范德华半径及不同氧化态、不同配位情况下的离子有效半径(由实验方法得到的)有如下一些规律。
(1)同一种元素的离子半径,阳离子由于失去电子,其半径小于原子半径,正电价愈高,半径越小;阴离子由于获得电子,其半径大于原子半径,负电价越高,半径越大。
(2)同一周期的元素,在周期表的水平方向上,原子半径和离子半径随原子序数的增大而减小;同一族元素,即周期表的垂直方向,其原子、离子半径随元素周期数的增大而增大。由此可见周期表的左上方至右下方的对角线方向,原子半径和离子半径接近。

图2-10-1 一层球体最紧密堆积
(3)在镧系和锕系,其原子和离子半径随原子序数的增加而减小,这一现象称镧系、锕系收缩。
原子半径和离子半径的大小,取决于它本身的电子层结构。同一种元素因电价不同,其半径各不相同。如铁元素,当为二价离子(Fe2+)时,其半径为0.78Å(1Å=10-10m);当为三价离子(Fe3+)时,其半径则为0.64Å。
在晶体结构中,呈球形的原子或离子相结合时,它们都趋向于尽可能的互相靠近,作最紧密的堆积,从而使晶体达到内能最小,使晶体处于最大的稳定性,如图2-10-1所示。从几何观点出发,同种原子之间的结合,可以看作是等大球体的最紧密堆积,不同半径的离子结合时,可以看作是不等大球体的堆积。
实践证明,不论是哪一种最紧密堆积形式,等大球的最紧密堆积中,看每个球的周围都有12个球,就称其配位数是12。在晶体结构中,每个原子或离子周围所邻接的原子或异号离子的数目,称为该原子或离子的配位数(Coordination Number,标记作C.N.)。若将一个原子或离子所邻接的原子或离子的中心联结起来,可构成一个多面体,称为配位多面体。在等大球的最紧密堆积中,其配位多面体是立方八面体或切顶底的两个三方双锥聚形。
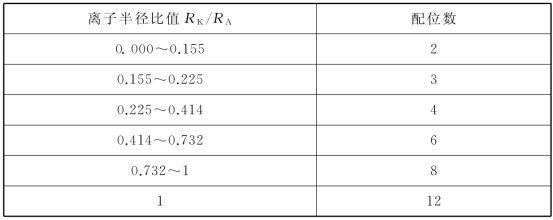
在离子键性的晶体结构中,阴离子半径大,常作最紧密堆积,如果这时的阳离子能与阴离子互相接触,则最稳定。但是一般阳离子半径总是小于阴离子半径,若是阳离子过小,又会使晶体结构不稳定,而引起配位数的改变。所以离子的配位数的多少,取决于两离子半径的相对大小。阳离子配位数与阴、阳离子半径比值RK/RA的关系如表2-10-1所示。表中列出了阳离子半径RK和阴离子半径RA的比值,以及阳离子配位数。
但是在实际晶体结构中,有的阳离子的配位数并不与表2-10-1所列的数据完全相符,其原因为影响配位数大小的因素除阴、阳离子半径比值之外,还包括化学键、离子的极化,甚至还有形成时的温度、压力等的因素。
表2-10-1 阳离子配位数与阴、阳离子半径比值RK/RA的关系
(二)离子的极化与化学键
如上所述,原子或离子在作最紧密堆积时,是把它看做刚性的球体。但实际上,任何原子或离子在其周围电磁场的作用下,都会有或多或少的变形。这种现象称为离子的极化。
极化过程有主极化(即极化周围的离子)和被极化(即自身被周围的离子所极化)之分。一般是阳离子半径越小、电荷越集中、电价越高,则极化能力越强,易发生主极化;而阴离子半径越大、电价越低,则易被极化。极化后使离子的正、负电荷重心相对偏移,使离子发生变形。两个离子的电子云发生重叠及阴、阳离子之间的距离缩短,而致使RK/RA之值改变,配位数也改变。例如:闪锌矿根据表2-10-1数据计算,ZnS半径之比值(RK/RA)为0.456,阳离子配位数应为6,但实际上为4,这是由极化影响所引起。
极化还直接影响着阴、阳离子之间的结合力,即化学键。离子的极化愈强,结合力愈强,则愈倾向于向共价键过渡。
使元素结合在一起的作用力称为化学键。主要的化学键有:离子键、共价键、金属键、分子键和氢键等。它们分别主要存在离子晶格、原子晶格和分子晶格中。与宝石学紧密相关的化学键,主要有离子键和共价键。
1.离子键(又叫电价键)—离子晶格
离子键为阴离子和阳离子之间靠库伦引力相维系,其中每个离子可同时与几个异号离子相结合,从各个方向相吸引,所以离子键无方向性和饱和性。这种离子键形成离子晶格。离子配位数较高,异号离子间常有一定的数量比例,以保持电价平衡。例如:萤石CaF2具有典型的离子键,如图2-10-2所示。
Ca2+周围有8个F-,F-周围也有4个Ca2+所围绕。F-和Ca2+之间靠静电引力即离子键来维系,形成离子晶体。离子晶体无自由电子存在,所以常是不良导体,由于电子皆属于一定的离子,质点间的电子密度很小,对光的吸收也比较少,光易于通过,所以其折射率及反射率均较低,多为透明到半透明,具非金属光泽。离子键的键力还是比较强的,故晶体的膨胀系数较小。因离子键的强度与电价乘积成正比,与半径之和成反比,所以它的机械稳定性较强。在硬度、熔点、热膨胀性等方面,则是随离子半径大小,电价高低而异,故其变动范围很大。宝石矿物绝大多数是离子键晶体。

图2-10-2 萤石晶体结构的两种不同的表示方法
2.共价键(又叫原子键)—原子晶格
共价键是原子间靠共用电子对的方式来维系。形成原子晶格,它受原子中电子壳构型的控制。其特征为具有方向性和饱和性。因此原子晶格中原子难以呈最紧密堆积,配位数也较低,通常原子晶格共价键是具有相当强的连接力。所以具有共价键的晶体具有较高的硬度和熔点,为绝缘体,透明到半透明,具玻璃—金刚光泽。与键的强度有关的物理性质的差异,亦随原子半径的大小及化合价而异。金刚石的硬度最高就是共价键很好的实例。
3.金属键—金属晶格
除上述离子键和共价键之外,还有金属键、分子键、氢键等。金属键大多存在于金属矿物之中。因价电子围绕着阳离子,这些电子不受原子核的限制,所以能在物体中自由漫游,使得金属具有延展性、高密度、低硬度、导电性、导热性、不透明、反射率高、金属光泽等金属性质。例如镶嵌首饰用的黄金、铂金的性质皆为这种键性。
4.分子键—分子晶格
关于分子键则是中性分子之间微弱的维系力,亦称温德华键。在具有分子晶格的宝石材料中,分子内部通常为共价键,分子间以分子键结合。所以一般具有分子晶格的晶体多为熔点低、热膨胀率大、导热率小、硬度小、可压缩性大,也有很大的电学及光学性质的变化范围。具有分子键的宝石材料大多透明而不导电。
其他还有在晶格中期重要作用的氢键、过渡型键等,表现为处于离子键向共价键过渡,共价键向金属键过渡等。实际行在实际晶体中存在的往往是不同程度的过渡键现象。
二、元素的离子类型及地球化学分类
化学元素在矿物中可呈离子、原子或分子状态存在,而大多数为离子状态。离子性质相近者所形成的矿物,在其成因和性质上也往往有相似之处。至于离子性质和离子间的结合关系,则主要决定于离子的电子层结构,离子外层电子层结构与它们之间的变化规律和元素在周期表上的位置有关。根据离子最外层结构不同,可将元素分为几种离子类型,这与元素按自然作用及其地质作用的活动规律进行的简单分类也是基本一致的。元素的离子类型及分类如表2-10-2所示。
表2-10-2 元素的离子类型
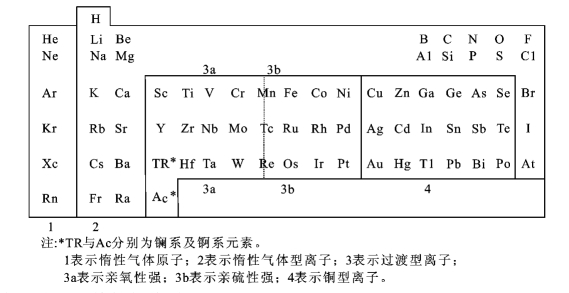
1.亲气元素——惰性气体原子
2.亲石元素——惰性气体型离子
这类元素的离子最外电子层结构与惰性气体原子相似,最外层电子数为2(s2)或8(s2p6),主要位于周期表的左方,如K+、Na+、Ca2+、Mg2+等阳离子和F-、Cl-、O2-等少数阴离子。它们的离子半径较大、极化能力较弱,在地质作用过程中易与氧结合形成氧化物或含氧盐,主要是形成硅酸盐,即绝大多数造岩矿物是这类离子的化合物,故有“造岩元素”“亲氧元素”或“亲石元素”之称。它也是组成宝玉石的主要元素。
3.亲铁元素——过渡型离子
这类元素的离子最外层电子数介于8到18之间,大都居于周期表的中间,处于惰性气体型离子与铜型离子之间的过渡位置,如V、Cr、Mn等。其离子半径与极化性能也介于两者之间。在地质作用过程中最外层电子数愈近8的,其亲氧性能愈强,愈趋于形成氧化物(表2-10-2中的3a);最外层电子数愈近18的,亲硫性能愈强,愈趋于形成硫化物(表2-10-2中的3b)。处于较中间位置的Mn、Fe等离子,则既可形成氧化物,又可形成硫化物,如赤铁矿Fe2O3及黄铁矿FeS2等。在宝玉石矿物中,有这类离子存在,则易使宝玉石呈色,故又有“色素离子”之称。
4.亲铜元素——铜型离子
这类元素的离子最外层电子数为18(s2p6d10)或18+2,主要位于周期表的右方,如Cu2+、Pb2+、Zn2+等。它们与铜离子性质相似,其离子半径较小、极化能力较强,在地质作用过程中易与硫结合形成硫化物,为主要的金属矿物,而且常集聚成矿,故有“造矿元素”“亲铜元素”“亲硫元素”之称。
5.亲生物元素
在表2-10-2中亲石元素的右侧C、H、O、N、S、P、Si等,常是组成生物的元素,故又有“亲生物元素”之称。
三、类质同象
在晶体结构中某种质点(原子、离子、分子或阴离子团)为另一种类似的质点所代替,而保持原有的晶体结构不变,只是使晶体常数发生很小变化的现象称类质同象代替(置换)。代替某质点A的物质B称为类质同象混合物。
例如:橄榄石族中的镁橄榄石Mg2[SiO4]和铁橄榄石Fe2[SiO4]之间,因Mg2+、Fe2+离子之间半径相近(MgRi=0.66Å,FeRi=0.74Å)电价相等,都为2价,所以它们之间可以任意比例互相置换,从而形成各种不同的类质同象混合物,可成为一个Mg、Fe各种比值的连续类质同象系列,而物理性质也随之改变。

类质同象混合物中,代替某一元素的物质称类质同象混合物,含有类质同象混合物的晶体,可称混合晶体,或称混晶。
类质同象混合物是一种固溶体。所谓固溶体是指在固态条件下一种组分溶于另一种组分之中而形成的固体。可以是由质点的代替形成“代替固溶体”也就是类质同象混晶,也可以是由某种溶质侵入他种晶格的空隙而形成“侵入固溶体”。这种侵入固溶体在宝石矿物中很少存在,而“代替固溶体”也就是类质同象混晶则较为广泛存在。
类质同象置换是有条件的,其内在条件主要是质点的半径、电价、化学键等,外在条件为温度、压力、介质等。现分述如下。
(一)代替与被代替质点的半径要相近
质点相对大小直接影响着配位数,是决定晶体结构的重要因素。若以r1和r2代表两个大小半径不同的离子,则形成以下不同情况。
(1)当两离子半径之比(r1-r2)/r2<0.15时,可发生无限的置换,如橄榄石,Mg半径为(0.066nm)、Fe半径为(0.071nm),两者的差率为7.5%,Mg、Fe之间可以任何比例互相代替,则形成完全类质同象。
(2)当两者离子半径之比(r1-r2)/r2为0.15~0.25时,离子间代替只限制在一定范围之内,如闪锌矿(ZnS)中的Cd(Zn的半径为0.068nm,Cd为0.088nm,两者半径差率为29%)部分Zn为Cd所代替,最多只能代替4%,形成不完全的类质同象,而在高温条件下则能形成完全的或更大部分的代替,但当温度降低时即发生离溶。
(3)当两者离子的半径之比(r1-r2)/r2为0.25~0.40时,在低温下则不能形成类质同象。即便是在高温下也只能形成有限的代替,成为不完全的类质同象。
(二)电价的总和要平衡
代替与被代替的离子的总电价要平衡。根据互相代替的溶质电价是否相等,可分为等价代替和异价代替。例如:橄榄石(Mg,Fe)2[SiO4]中的Mg2+、Fe2+代替就是等价代替;而斜长石Na[AlSi3O8]—Ca[Al2Si2O8]的置换系列中Na+Si4+代替Ca2+Al3+时,Na+和Ca2+之间、Si4+和A13+之间的代替为异价类质同象代替。在元素周期表中,对角线方向的离子半径大小近似,一般右下方向的高价元素易代替左上方的低价元素,这一规律又称对角线规则(表2-10-3),从而形成异价类质同象。
表2-10-3 异价类质同象代替的对角线法则
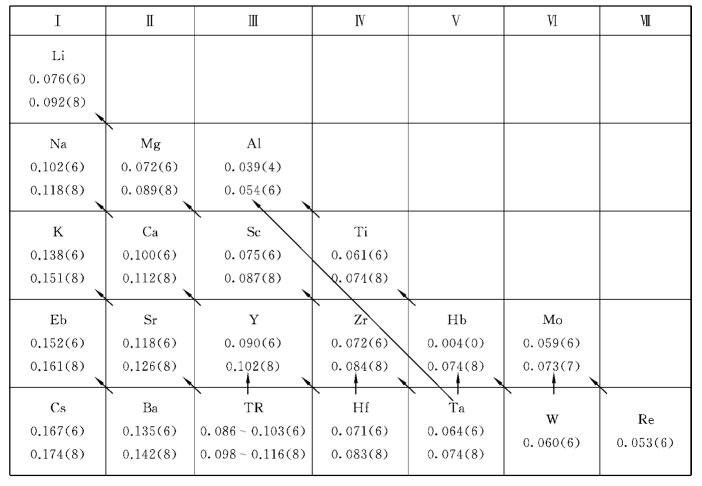
注:表中的数据为离子有效半径,单位为nm;括号中的数字表示配位数。
(三)化学键要相似
化学键性质主要取决于离子外层电子层结构即离子类型。离子类型相同者,其极化性质相似,代替后化学性质改变不大,只要它们的半径相差不多,即可形成类质同象。如果两元素的离子类型不同,即便是半径相近,也不能互相代替,如Na+和Cu+的离子半径(Na的离子半径为0.097nm,Cu为0.096nm)相差甚微(1.04%),但Na+属于惰性气体型离子,Cu+属于铜型离子,两者离子性质不同故不能形成类质同象代替。
(四)热力学条件
温度增高有利于类质同象代替,这可能是由温度升高、溶质膨胀、半径增大、质点间半径差率减小、空隙体积增大所致。例如:钾长石K[AlSi3O8]中Na+代替K+,一般不超过30%,在高温条件下可以超过这一比例,甚至可以100%代替,而形成完全类质同象。
(五)组分浓度
在矿物质形成过程中,如果某一组分浓度不足,将促使类似组分的代替。例如:磷灰石Ca5[PO4]3(F,Cl)形成时,介质中P2O5的浓度较大,或CaO的含量不足时,则Sr、Ce可补偿Ca而进入磷灰石晶格中,占据Ca的位置形成补偿类质同象。
此外,还有氧化还原电位对类质同象也有一定影响。关于压力问题,一般认为压力增大可限制类质同象置换范围,反而是促进固溶体的离溶这一问题尚待进一步研究。
研究类质同象,可进一步加深对宝石矿物化学成分、晶体结构、物理性质及形成环境之间关系的理解,尤其对矿物化学成分的可变性给予了深入的揭示。由于宝石矿物化学成分的变化可引起某些物理性质的变化,因而根据某些物理性质,如颜色、密度、硬度、折射率等的变化,又可确定或探讨宝石矿物成分的变化。
但是要注意,在宝石矿物晶体中,有时有外来混入物,这些混入物不占据晶格位置,只呈机械混入物,即杂质状态存在;另包体状态存在虽然也能引起宝石矿物物理性质上的局部变化,但它不是宝石矿物成分的改变,且不能与类质同象混入物相混淆。
四、类质同象物质的分解(固溶体离溶)
如前所述,温度的升高有利于宝石矿物中类质同象代替,而温度的降低和压力的增大不但可促使类质同象代替减弱,而且可以使已形成的类质同象混合晶体分解,也称固溶体离溶。被离溶出来的晶体,常受主晶晶体结构的控制,而在主晶体中呈定向排列存在。通常如长石类中的钾长石(K[AlSi3O8])在高温条件下,钾可被钠代替。当温度降低时,钠离子即离溶出来,以钠长石的形式成细小的条片状存在于钾长石中,形成具有晕彩的月长石(月光石)。又如,刚玉(Al2O3)在高温条件下,钛(Ti)可代替铝成为固溶体,当温度降低时,可形成均匀的晶质体蓝宝石。而温度降低缓慢时,钛即可离溶出来,同时与氧结合,形成针状金红石(TiO2)。由于受刚玉为六方晶系的控制,针状金红石可互成60°排列。当刚玉被切割成弧面宝石时,足够的金红石晶体就会产生星光效应。
五、同质多象
同质多象是指化学成分相同的物质,在不同的物理、化学条件(温度、压力、介质条件)下,形成两种或两种以上晶体形态、性质、结构完全不同的晶体现象。所形成的物质,称同质多象变体。每种同质多象变体,都是一个独立的矿物种。如碳的同质多象变体为金刚石和石墨。两者的内部结构、形态、性质完全不同,如图2-10-3及表2-10-4。

图2-10-3 金刚石与石墨内部结构对比
表2-10-4 金刚石和石墨的对比(https://www.xing528.com)

一般同种化学成分的变体,形成2种变体时称同质二象;形成3种变体时称同质三象;可形成3种以上变体时称同质多象。如水晶的变体就有8种之多。如图2-10-4所示。
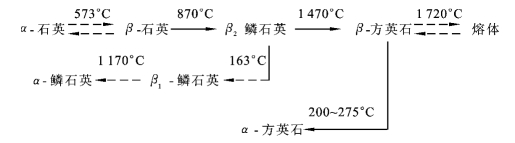
图2-10-4 石英的同质多象变体
六、胶体吸附
地表由于矿物或岩石遭受风化而被破坏,或由于各种化学作用引起分子凝聚,可产生胶体宝石矿物。
胶体宝石矿物是指胶体溶液在凝结之后,会有较少量的水而成的胶凝体。如蛋白石SiO2·nH2O胶凝体随着时间的加长而失水,逐渐由非晶质变为隐晶质,甚至为显晶质,这称为胶体老化,又称晶化作用。经老化形成的矿物称为变胶体矿物,如蛋白石失水老化而形成的隐晶质玉髓或显晶质石英。在宝石矿物中还有一种比较常见的结晶胶溶体,它实际上是含有机械混合物包裹体的晶体,例如乳白色水晶中有极细小的气体或液体溶质,黑色方解石中有极小的有机质溶质或硫化物,黄铁矿中含有铜或金等。
胶体微粒具有很大的表面能和吸附作用,是胶体的主要特性,多数无机质胶体溶质是晶质的,其表面键性未饱和,带过剩正电荷的称正胶体,反之称负胶体。在自然界中负胶体多于正胶体,在地壳中常见的负胶体有SiO2胶体、腐殖质胶体等。正胶体有Zr、Ti、Ce、Cr、Cd、Fe、Al的氢氧化物等。负胶体可吸附介质中的阳离子,如MnO2负胶体可吸附Cu、Pb、As、Sb的硫化物等数十种阳离子;正胶体吸附阴离子,如Fe2O3正胶体可吸附P、Cr、V等元素,且呈[PO4]3-、Cr2O2-4等阴离子团的形式存在。目前在我国珠宝玉石市场上出现的金香玉,是种富有巧克力香味的玉石。根据我国的一些学者研究认为,其香味就是在岩石形成过程中,吸附了一些有香味的有机物质造成的。
胶体的吸附作用是胶体矿物化学成分不很固定的原因,但胶体吸附的溶质并不参加晶格,因此不把它计入矿物的化学成分之中。
七、宝石矿物中的水
水是某些矿物中的重要组成部分。含水宝石矿物的某些性质往往与水的存在有关。根据形成条件不同及在宝石中的存在方式和与其他组分结合方式的不同,可对宝石矿物中的水进行分类。
(一)吸附水
吸附水为中性水分子H2O,以气态、液态或固态被机械地吸附于矿物颗粒表面、矿物的细小裂隙或某些矿物的晶格空隙之中,不参加晶格构造,也并不固定,随温度不同而变化,当温度升高到110℃时全部散失。
吸附水可以有以下几种情况。
(1)气态水。它是和空气一起渗入到宝玉石当中,呈水气泡存在。
(2)湿存水。它是随空气湿度增大而集聚在矿物表面,形成水的薄膜。
(3)液态水。它可以以水膜包围矿物颗粒,称薄膜水;也可以填充于矿物和矿物集合体的细小裂隙,以毛细作用进行扩散,称毛细管水。
(4)胶体水。它是在水胶凝体矿物中所含的水,如蛋白石SiO2·nH2O中的水。胶体水是计入矿物化学组成的,水含量变化很大,n表示H2O分子的含量不固定。
(5)固态水。它是在低温下以冰的形式存在于矿物中。
(6)包体水。它是以液体或气体形式存在于晶体当中,往往是在宝石矿物形成前或形成后被包裹进来的,平时当温度升高时它也可以由液态转化成气态;当温度降低时也可由气态转化成液态;只有当晶体破坏时方散失。但有的包体水是人工注入的,冒充天然水者例外,属作假而为。
(二)结晶水
结晶水是以中性水分子H2O的形式,参加晶格结构的结晶水化物的水。水分子和其他组分在数量上有一定的比例,起着结构单位的作用。或以一定的配位形式围绕着阳离子;或围绕着阴离子形成水合离子。在晶格中结合牢固,其脱水温度一般在300℃左右,少数可达600℃。脱水后晶格破坏,形成另外的无水化合物。如石膏Ca[SO4]·2H2O,属单斜晶系,脱水后转变为硬石膏Ca[SO4],属斜方晶系。
(三)结构水
结构水是以(OH)-、H+、H3O+离子的形式存在于某些宝玉石矿物的晶格之中,其中以(OH)-最为常见。如磷灰石Ca5[PO4]3(F,Cl,OH),黄玉Al2[SiO4](F,OH)2等,它们在宝玉石矿物中与其他结构组分联系是很牢固的,大部分在600~1 000℃的高温下才能以水的形式逸出,水逸出后晶格破坏,结构重新改组。但也有学者认为中性水分子H2O和带电荷的氢氧离子OH-之间有着本质的不同,在含水宝石矿物中不应该包括这一类型。
实际上在一种矿物中同时可存在几种类型的水,如在绿松石CuAl6[PO4]4(OH)8·4H2O中,除经常有不固定的吸附水外,同时还存在有结晶水及结构水。
研究宝玉石中的水,以差热分析及红外光谱分析法是最有效。
八、宝石矿物的化学成分及表示方法
(一)宝石矿物的化学成分
宝石矿物的化学成分是组成宝石矿物的基础,是决定宝石矿物物理化学性质的基本因素。因为成分和构造是内因,它决定着宝石矿物的性质。而地壳的化学成分是形成宝石矿物及其他各种矿物的物质前提。
众所周知,组成地壳的各种元素已经都列于元素周期表中。各种元素在地壳中的含量却存在着很大的差异。各种元素在地壳中的平均含量称元素在地壳中的丰度。即各种元素在地壳中的丰度相差是很多的,丰度最大的元素是氧,氧占46.6%,而最小的是氡,氡占7×10-16。在质量上可相差1017倍之多。单说O、Si、Al、Fe、Ca、Na、K、Mg这8种元素就占了地壳总质量的98.59%。其中O几乎占到地壳总质量的一半,Si占到四分之一还多。地壳中化学元素的平均含量的质量百分数称“质量克拉克值”,由于各元素的原子量不同,原子数目是起决定性作用的,因而每一元素的质量克拉克值除以该元素的原子量,通过计算得出各种元素的“原子克拉克值”。也就是说,如果将它们的质量百分比换算成原子百分比、进而换算为体积百分比的话,可见O的体积可占地壳体积的93%以上。这样看来地壳上元素丰度的差异是惊人的。而为什么有这样的差异,其根本原因是其原子核的结构和稳定性。元素周期表上,随着原子序数(Z)的增加,大核内质子间的斥力增加大于核力的增加,原子核内结合能力降低,则原子核趋向不稳定,元素丰度也自然降低。元素丰度高的元素分布于元素周期表的前端,愈后则丰度愈趋于降低。在宝石矿物中的一些常见元素,自然也主要是元素周期表中的丰度最大的和较大的元素,依次排列为:氧(O)、硅(Si)、铝(Al)、铁(Fe)、钙(Ca)、钠(Na)、钾(K)、镁(Mg)和钛(Ti)、氢(H)、碳(C)、氟(F)、铍(Be)、铬(Cr)、铜(Cu)、锆(Zr)等。地壳中分布最广的8种元素如表2-10-5。
表2-10-5 地壳中分布最广泛的8种元素(据Mason,1966)

注:表中原子克拉克值数值是仅根据质量克拉克值最大的前8种元素的原子因数所作的计算结果。
宝玉石矿物的形成不管与元素的相对数量有关,而且也为地球化学性质所决定。有些元素的丰度值很低,但它趋向于集中形成独立宝玉石矿物种,也可富集成矿,如Au、Ag、Sb、Bi等,可称为“聚集元素”。另外有些元素丰度虽然较上述元素高,但趋于分散,不易聚集成矿,或很少形成独立矿物,只是常以微量混入物赋存与其他矿物中,如Ga、In、Rb、Cs等,这些被称为“分散元素”。另外有资料称,在1m3的岩石里,可分析出周期表上所有的元素,包括各种丰度大小的、各种稀有的和分散的元素。只不过有的含量甚微而已。这是事实,稀有的分散的元素确系以微量的存在于各种岩石中。
再看宝石矿物的化学成分,可以分为两种类型:一类是由同种元素的原子相结合的单质,如钻石成分为碳(C)、自然金成分为金(Au)等;另一类是由各种元素组成的化合物,化合物又可以分为简单化合物如萤石(CaF2)、石英(SiO2)和复杂化合物如镁铝石榴石(Mg3Al2[SiO4]3)、白云石(CaMg[CO3]2)等。从化合物的类型看,可以分为以下几类。
(1)自然元素大类形成单质宝石矿物(如钻石C)。
(2)硫化物大类(如黄铁矿FeS2)。
(3)氧化物大类(如石英SiO2)。
(4)含氧盐大类。包括:①硅酸盐类(如橄榄石(Mg,Fe)2[SiO4]),这一大类中的宝石矿物最多;②磷酸盐类(如磷灰石Ca5[PO4]3(F,Cl,OH));③硫酸盐类(如重晶石BaSO4);④碳酸盐类(如方解石CaCO3)等。
(5)卤化物大类(如萤石CaF2)等。
(二)宝石矿物化学成分的表示方法
宝石矿物化学成分的表示方法有两种:一种为实验式,另一种为晶体化学式。
1.实验式
实验式只表示宝石矿物的组成元素的种类及其数量,如祖母绿为Be3Al2Si6O18或用氧化物表示为3BeO·Al2O3·6SiO2。它不能反映原子在宝石矿物中的结合情况及结构特点。因此只有当某一宝石矿物的结构研究不够、结构不清(往往是新发现的新矿物)或在某种专门需要的情况下,才用这种实验式来表示。
2.晶体化学式
晶体化学式又称结构式,或简单地称为化学式,它是以化学全分析的结果和X射线结构分析资料为基础,并以晶体化学的基本原理为依据计算出来的,如上述祖母绿的晶体化学式应为Be3Al2[Si6O18],它不仅能反映组成宝石矿物元素的种类及其数量比,而且还能反映宝石矿物结构的特点及元素间的结合关系。如上所述的祖母绿的晶体化学式既表明了其成分中有阴离子团[SiO6O18]12-的存在,又表明其与阳离子Be、Al相结合的关系。晶体化学式的表示方法如下。
(1)将阳离子写在前面,复盐中按碱性由强到弱顺序排列;阴离子和阴离子团写在后面,阴离子团用[]括起来,如海蓝宝石Be3Al2[Si6O18]。
(2)呈类质同象关系的离子,需括在“()”内,用“,”分开,含量多的离子写在前面。如镁橄榄石的化学式为(Mg,Fe)2[SiO4],以表示含镁为主。
(3)附加阴离子写在阴离子或阴离子团之后,如磷灰石的化学式为Ca5[PO4]3(F,Cl,OH)。
(4)含水化合物的水分子写在化学式的最后面,用“·”隔开,如含水量不固定时,可以nH2O或“aq”表示。如蛋白石的化学式可写作SiO2·nH2O或写作SiO2·aq。
九、包裹体
宝石矿物晶体中的包裹体,简称包体。它是在宝石晶体形成过程中,捕获的一些与宝石晶体本身成分无关的物质。如在水晶中常有液态包体,或其他矿物(如金红石、绿帘石等)固态包体。晶体中的包体一般有大有小,有的肉眼可见,有的要在放大镜或显微镜下放大检查时才能看到,它在宝玉石中普遍存在。对包体要注意观察其类型,大小及所占的比例,颜色,形状,气、液、固态百分比,分布状况等。天然宝石可有天然矿物包体,人工宝石则无天然矿物包体。但是可能有人工合成时因混落进容器中的碎屑物质而形成的白色、面包渣状不透明的熔质包体。
包体成分不计入所在矿物的化学成分之内。
(一)天然宝玉石中的包体
天然宝玉石中的包裹体从成因上可分为先生型、同生型和次生型。
1.先生型
先生型是在宝石晶体形成前就已存在的,是在宝石晶体生长过程中所俘获。它常是圆钝形的或侵蚀状的,也可有尖锐的或棱角状的。这是包体在生成主体宝石的环境中局部熔蚀的结果。
2.同生型
同生型是和宝石晶体一起同时从相同的熔体或溶液中结晶出来,如石英晶体中的石英晶体、钻石中的橄榄石等。同生包体一般呈尖锐状及棱角状。同生液相包体、气体及液体、液体及固体、气体和固体等皆有,它揭示了晶体形成于溶液之中,所以它提供了晶体生长过程的化学环境、温度、压力等重要信息。宝玉石中常能观察到的其他同生特征是双晶(如刚玉和长石类的双晶)和色带(如某些蓝宝石和紫晶中的色带)等。
3.次生型
次生型是在主体宝石形成后形成的包体。它多是由于化学条件的改变,液态包体结晶出熔,外来物质掺入到晶体裂隙中或辐射引起的结构破坏等因素形成。例如针状金红石包体是刚玉等晶体出熔时形成的。石英中的铁锰质树枝体即是外来物质渗入石英裂隙中产生的。
也有根据包体的成因,将包体分为原生包体和次生包体。
(1)原生包体为宝石矿物在成矿溶液中生长时把母液包含在晶体内,从成矿介质中同时晶出成气液包体,如绿柱石中的晶体多沿C轴方向平行排列,有的包体还有着与绿柱石相似的六方柱面形状。这与绿柱石的结构有关。
在石英晶体中的这类包体,多呈不规则状分布,很少有沿C轴方向平行排列的,在垂直C轴切面上也可见到少数偶有呈六边形者。这与石英的六方柱晶面发育有关。
(2)次生包体从形成时间上看是属于后生。它是在晶体形成后受构造运动影响产生的裂隙,晚期成矿溶液充填裂隙时形成。这种包体可与晶体的外部连通,如图2-10-5(a)所示。
原生包体平行于晶体生长面和系统边缘排列,而次生包体沿一个以上世代的愈合裂隙分布。
在检测宝石过程中通常是将包体分为固态包体,气态包体,液态包体,气液两相包体,气液固三相包体。生长现象包括双晶、色带和旋涡状痕迹等。
(1)固态包体可以是宝石主体的同种矿物,也可以是与宝石不同的矿物。宝石矿物中的常见包体,如表2-10-6所示。有呈针状、毛发状的包体(如水晶中的针状、毛发状金红石包体);也有呈管状者称之为管状包体;有片状者称之为片状包体(如水晶中的绿泥石片状包体)或呈晶体状(如水晶中的尖晶石包体)等如图2-10-5(b)。
表2-10-6 宝石中最常见的包体
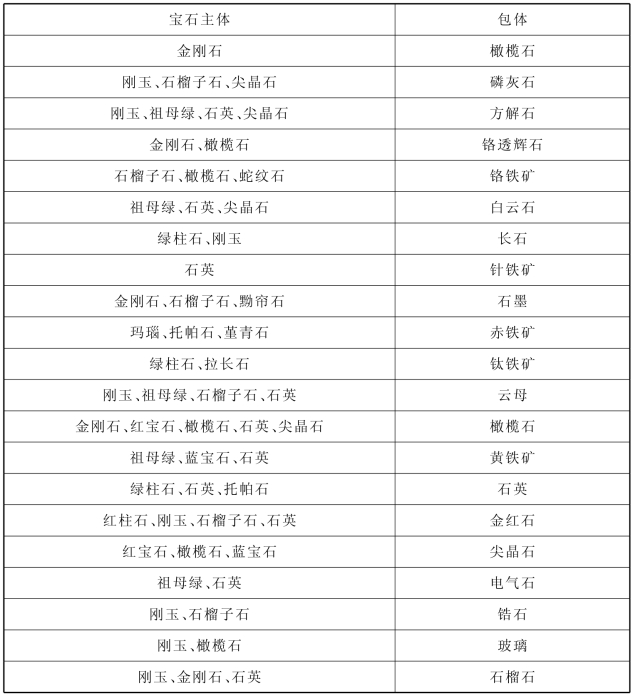
(2)液态、气态和固态包体是指晶体内的空洞中可被气体、液体充填,或被气体、液体和固体所充填,故有气液两相包体和气液固三相包体。一些次生弥漫状带也可被称为“指纹包体”。
(3)严格地说生长现象不属于包体,而是一种宝石的内部特征。它是由于晶体稳定生长速度的间断造成的,这可以是晶体溶液化学成分的变化或环境温度的改变所引起。天然宝石中主要的生长现象是双晶、色带、色斑和旋涡状现象等,这些常可作为宝石形成方式的研究依据。
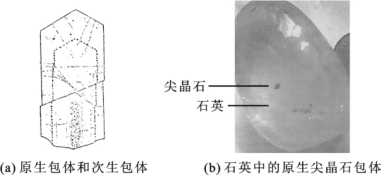
图2-10-5 石英中的包体
(二)合成宝石和仿制宝石中的包体
人工宝石材料中常有气泡、圆形、棱角形、烟雾状、扭曲包体,或串珠状、小管状孔洞、弥漫状熔质俘虏体(有时称窗纱状包体),或滴状、球形物。典型的是铂金片,它来源于人工制造的铂金器皿,还有的有尘埃状“面包屑”包体。如今合成金刚石中含有铁或铁镍熔剂的包体,使合成金刚石具有天然金刚石所不具有的磁性。玻璃制品中球形、拉长形、管状形气泡最多,但它们往往是分散的不规则排列,而天然宝石中的气泡则往往是比较集中的分布。水晶中的常见气液包体,合成宝石可有助熔剂包体等如图2-10-6所示。
当前对宝石的优化处理已颇为常见,这些人工宝石或宝石材料皆以无天然矿物包体为特点。这也是天然宝石矿物与人工宝石的重要区别。
有些较大的包体人的肉眼可以看见;小的可以用10×、20×放大镜观察到;很小的包体,精确测定还是要靠宝石显微镜进行观察。

图2-10-6 水晶、合成红宝石中的包体
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




