1.离子键
在一定条件下,活泼金属原子和活泼非金属原子相互接近时,前者将失去最外层电子而形成带正电荷的阳离子;后者将获得电子而形成带负电荷的阴离子。阳离子和阴离子之间将由于静电引力而互相吸引,但当它们充分接近时,就会因离子的电子云重叠而产生斥力。当吸力和斥力相等时,可形成稳定的离子键。例如钠原子和氯原子在一定条件下互相接触时,钠原子有一个3s1价电子处于稳定的八个电子所组成的壳层以外,而氯原子有七个价电子3s2p5,需要一个电子以组成八个电子的稳定壳层。因此,钠原于将失去一个电子而成为带正电荷的Na+离子,氯原子将夺得一个电子而成为带负电荷的Cl-离子。这两种离子由于相互间的静电引力而彼此吸引,直至引力被电子云重叠产生的斥力所平衡为止,形成离子化合物。离子键的特点是没有方向性和饱和性。例如,一个Na+离子可以同时和几个Cl-离子相结合,一个Cl-离子也可以同时和几个Na+离子相结合,而周围的Cl-离子或Na+离子的数目和排列方式则取决于所形成晶体的密排形式。在氯化钠晶体颗粒中,并不存在单个的氯化钠分子,化学式NaC1只代表氯化钠中Na+和Cl-离子的数比,并不代表分子。所以离子结合没有饱和性。另外离子的电荷分布是球形对称的,它在各个方向都可吸引电荷相反的离子,所以离子结合没有方向性。
离子型晶体的结合较强,破坏这种化学键需要较高的能量。所以离子型晶体的熔点、硬度、强度都很高,热膨胀系数很小。例如用作耐火材料的MgO、A12O3和钢中的一些非金属夹杂均属此类化合物。
离子型化合物的性质很大程度上取决于离子的性质,如离子的电荷、离子的半径、离子的电子层结构及晶体结构等。
2.共价键
共价键理论主要有现代价键理论(valence bond theory)和分子轨道理论(molecular orbital,MO)。现代价键理论强调了分子中相邻两原子间因共享配对的电子而成键,能相当直观并成功地解释物质的化学性质,预测物质的分子结构。但由于过分强调了两原子间的电子配对,而显示出它的局限性,例如小分子B2、O2等的顺磁性价键理论无法解释。分子轨道理论自然地、合理地解释了这些现象。
现代价键理论认为:电负性差异甚大的原子间靠离子键结合成分子,电负性相近甚至相同的原子是靠原子共享电子,形成共价键而结合成分子的。H2、H2O、NH3等单质分子和HCl、H2O、NH3等化合物分子是由共价键结合的。它们是通过价电子共有,形成稳定的电子满壳层(如2、8、18…个电子)的方式结合的。共价键的本质是原子共享电子,被共享的电子就像一个带负电荷的桥,把两个带正电荷的核吸引在一起。现代价键理论的理论要点如下。
1)配对成键 原子A和B各有一个未成对电子且自旋相反,可互相配对构成共价单键。若A与B各有两个或3个未成对电子,则能两两配对构成共价键或叁键,H-H,蒸气Li-Li分子为单键,N≡N分子为叁键等。H(1s)-C1(3p)可形成单键,而两个He原子不能形成分子,因为氦原子没有未成对电子。
2)饱和性-原子价数的确定 两原子中自旋相反的电子配对后,不能再与第三个原子配对一起形成共价键。若A原子有两个未成对电子,而B原子只有一个,则A能与两个B化合成AB2分子,如H2O。这些就是共价键饱和性的具体体现。共价键的饱和性是由“配对成键”所决定的。通常一个原子所含有的可以与其他原子配对的未成对电子数目是其原子价数。
3)方向性-电子云最大重叠原理 两原子的价电子发生重叠愈多,体系能量降低愈多,所形成的共价键愈稳固。共价键形成时尽可能采用电子云密度重叠最大方向,这是共价键具有方向性的原因。溴分子(Br2)形成时,溴(Br)有一个不成对的3p态电子云,两个溴原子的两个3p态电子云只有在“迎头”重叠时,才发生最大有效重叠而成键,如图2-10所示。

图2-10 成键轨道的有效重叠方向
4)配位体 若原子A具有已配对的孤对电子,而B具有能量与之相近的空原子轨道,则A的孤对电子所占有的原子轨道与B的空轨道能有效地重叠,孤对电子为A与B共享,构成共价配键或配键,这样A被称为给电子体,而B则为受电子体。
5)成键方式 两个原子的原子轨道(价轨道)以“头碰头”方式重叠,形成沿键轴呈圆柱形对称的电子云,这种键称为σ键。例如,两个氢原子的ls电子形成H2;一个氢原子的1s电子与氯3p电子形成HCl分子;两个氯原子的3p电子的重叠形成Cl2。不同原子的原子轨道,如p轨道,以“肩并肩”方式重叠成键,这种键称为π键。π键电子云有一个通过键轴几率密度为零的平面(节面),并对称分布于该节面上下,但符号相反(反对称)。如乙烯CH2=CH2分子中两个碳的2p电子可构成一个π键。不同原子的价轨道,如d轨道以“面对面”的方式重叠成键,这种键称为δ键,见图2-11。δ键电子云沿两个通过键轴的节面呈对称分布。如Re2Cl82-中,两个金属Re的dx2-y2 轨道沿着z轴(Re-Re键轴)方向的重叠。一般共价单键由σ键组成;双键由一个σ键与一个π键构成,如乙烯中的C=C;叁重键则由一个σ键与两个π键构成,如乙炔中的C≡C键;四重键则由一个σ键、两个π键与一个δ键构成。键的多重性越大,总键能越大,键长将越短。成键σ电子云密集在两原子之间,键较强,而π和δ键电子云不然,它们的流动性较大,能量较高,较σ键易断裂,反应活性较高,因此,在多重键上易发生加成反应。
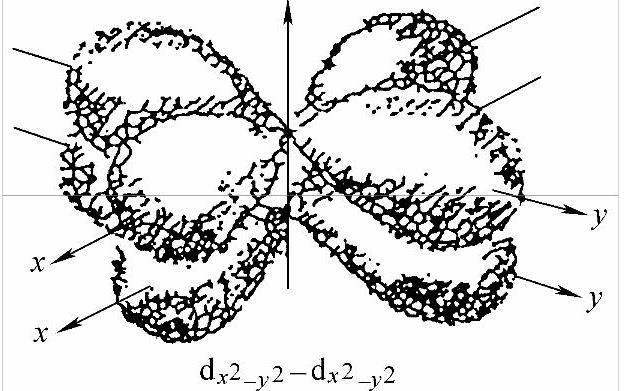
图2-11 δ键电子的共享方式
6)杂化轨道 实验证明,甲烷分子(CH4)具有对称性很高的正四面体的空间构型,分子内4个化学键是均等的,有很高的化学稳定性,分子偶极矩为零。这些事实用原子的未成对电子配对形成共价键的理论是无法解释的。为此逐渐发展起来了杂化的概念和杂化轨道理论,以下介绍这一理论的要点。
原子在成键时,先受到微扰——周围环境对它的某种作用而受到激发,以致使原子的某些能量相近的轨道可以重新线性组合成能量相等的一组新轨道——杂化轨道。原子轨道的线性组合称为杂化。具体地说,同一能级组或者同一能层的轨道如ns与np轨道或ns,np与nd轨道或(n-2)f,(n-1)d,ns与np轨道可按不同方式杂化。杂化后体系总能量将略高于线性组合的平均值。但杂化后的轨道改变了原来轨道的电子云空间角度分布,因而改变了原子成键的方向性,这是分子呈现一定几何构型的原因所在。不仅如此,杂化还可以提高原子轨道的成键能力。常遇到的杂化类型有sp型、spd型及dsp型。sp型又分为sp、sp2和sp3杂化;spd型又分为sp3d和sp3d2杂化,是由ns、np和nd原子轨道组成,主族元素常用其空的能量稍高d轨道参与杂化;dsp型则分为dsp2、dsp3、d2sp3杂化,是由(n-1)d、ns和np轨道组成。副族元素常用未充满的(n-1)d轨道参与杂化。
现在,具体看一下sp2杂化。以BF3为例,其中心原子硼的价轨道为2s2p1。在形成BF3过程中,B原子的一个2s电子被激发到一个空p轨道上,然后硼原子一个2s轨道与两个2p轨道杂化,形成了3个sp2杂化轨道。杂化过程示意如图2-12所示。
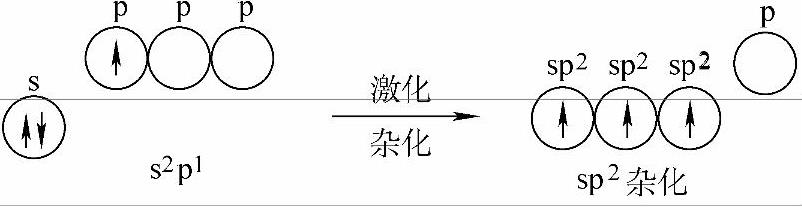
图2-12 sp2杂化
这3个sp2杂化轨道互成120o的夹角并分别与F原子的p轨道重叠,电子配对形成σ键,因而构成平面三角形分子,如图2-13所示。
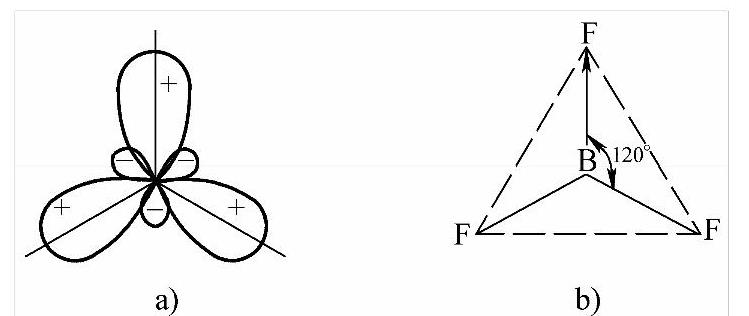
图2-13 杂化轨道角度分布示意图和BF3分子的空间构型
a)3个sp2杂化轨道角度分布 b)平面三角形结构的BF3分子
分子轨道理论(MO)它可看成是量子力学线性变分法求解H2+体系电子运动规律结果的推广。MO理论与VB理论是从不同侧面探索研究分子结构的方法。在许多问题上,这两个方法可得出一致结论。但有时则两法各有其优缺点。因此目前两种理论尚不可偏废。不过由于计算机等新技术的兴起、迅猛发展及广泛应用,MO理论方法已成为当代研究分子结构的最普遍和最基本的理论方法。MO理论的基本要点如下。(https://www.xing528.com)
1)分子中电子运动的整体性 原子中的电子在原子核为中心的力场中运动,可用原子轨道(atomic orbital,AO)波函数ψ来描述。分子轨道理论认为分子中的电子在整个分子的势场中运动,因此它们属于整个分子,用分子轨道波函数来描述,记以Ψ。类似于原子轨道,分子轨道也处于一系列分立的能级上。AO以主量子数来划分能层,用角量子数来划分能级,并用s,p,d,f,…来标记。MO则用希腊文σ,π,δ,…符号来标记其在键轴方向上角动量分量(量子化的)的大小(分别为l,2,3),并编以序号加以区分。│Ψ│2dτ同样表示电子在空间小体积dτ内出现的几率,而│Ψ│2是几率密度。
2)MO的构成MO由分子中各原子的原子轨道线性组合而成。其组合系数由量子力学变分法等确定。MO的数目等于组成分子的各原子的原子轨道AO数目之和,如两个原子的AO(ψ1,ψ2)可组合成两个MO(Ψ1,Ψ2),即
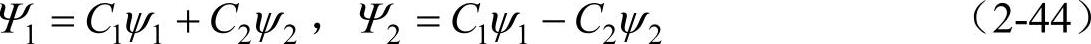
式中,C1,C2是线性组合系数(纯数)。组成的MO中通常一半是成键MO,即两个原子轨道相加重叠而构成的分子轨道Ψ1,一半是反键MO,即两个原子轨道相减重叠而构成的分子轨道Ψ2,有时还有未参与成键的为非键MO。例如,第二周期中的某些元素的同核双原子分子如O2,F2等的MO,可简单地由两个原子的1s,2s,2p的10个AO组合成10个MO,其能量由低而高,大致为:σ1s,σ1*s,σ2s,σ*2s,σ2pz,(π2px,π2py),(π*2px,π*2py),σ*2pz(右上角*表示反键分子轨道)。它们的能级和电子云示意图如图2-14所示。
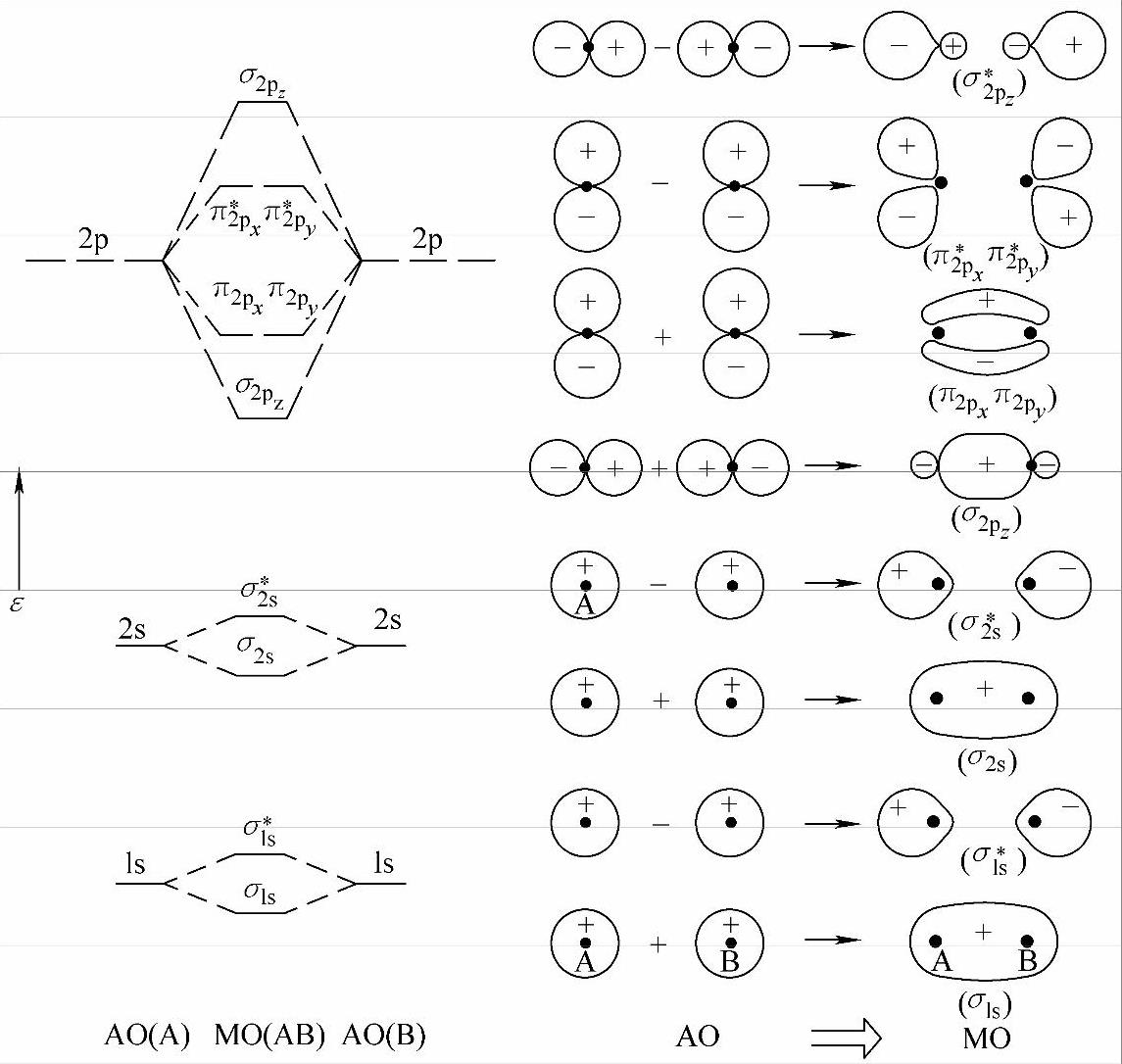
图2-14 AO构成MO及其电子云的示意图
3)MO的AO有效组合原则 两个原子只能由能量相近的两个原子轨道才能有效地组合成两个MO。两个原子轨道能量越相近,则所构成的成键MO越低于能量低的AO,而反键MO则越高于能量高的AO。若两个原子轨道能量相差悬殊,则不能有效组成MO,电子基本上仍在各自AO上运动。当不同原子的价电子轨道能量相近,而有效地组合成分子轨道时,由于不同原子的不同价电子轨道能量各不相同,因此组合时其系数各不相同,能量也不同;凡参与成键的AO之间其波函数ψ符号相同部分重叠得越多者,成键的MO能量越低,越稳定;对称性匹配的AO相互重叠时方可使电子云达到最大重叠;泡利原理、能量最低原则及洪特规则同样适用于电子在MO上的填充和排布。
3.金属键
周期表左面的元素均在满壳层外面有一个或多个价电子,这些填满的壳层在带正电的原子核和这些价电子之间起着屏蔽的作用,所以这些原子很容易失去它们的价电子而成为正离子。原子核的吸引力愈弱,则外面的电子“轨道”愈大。
在两个金属原子,例如两个钠原子互相接近的过程中,其(3s)“轨道”首先开始分裂。正如氢原子在相互接近时(1s)能级“轨道”发生分裂一样。如果这两个原子的(3s)“轨道”上的两个电子自旋相反,则结合成一个电子对,进入(3s)分裂后的较低能级的“轨道”,并使系统能量降低。假如又有一个也具有未成对的(3s)电子的钠原子接近这个电子对,则按照不相容原理,由于分裂后低能级的(3s)量子态已经填满,这个原子必然受到排斥。然而,实际上因为大量原子凝聚成固体时,最外面电子的能级展宽成带,钠的(3p)能级和(3s)能级发生重叠,所以第三个电子可以占据一个(3p)分裂后的低能级的量子状态以降低能量,当大量原子结合时,自旋相反的成对的价电子按不相容原理及能量最低原理排列在分裂展宽后(3s)及(3p)的较低能级的量子状态上,因而结合后系统总的能量下降。
上述金属原子分享价电子的设想,可导出金属键模型。在金属晶体中,金属原子上的价电子,在整个晶体内自由运动,金属晶体就是靠自由价电子和金属离子形成的点阵之间的相互作用结合在一起的。这种相互作用称为金属键。构成金属晶体的金属原子,由于价电子活动在整个金属晶体内,金属离子沉浸在运动的电子云雾中,所以电子云分布可以看成是球形对称的,整个原子可以看作具有一定体积的圆球,金属键没有饱和性和方向性。
金属的这个自由电子模型是德鲁特(Drude)在本世纪初提出的,它成功地对典型的金属作了定性的解释。金属自由电子的运动决定了金属的导电性,同时也决定了金属的其他一些特性。自由电子的运动以及原子本身的振动,使金属具有较大的热导率。金属内原子面之间作相对位移时,正离子仍和自由电子保持着结合键,因此金属具有可塑性。自由电子吸收可见光的能量使金属具有不透明性。因吸收能量而激发的电子,当回到原来的低能级时,就发生辐射,这使金属具有光泽。
泡林(Pauling)在20世纪30年代提出了解释金属结合力的另一种观点。他认为金属结合是起源于相邻原子间价电子所形成的共价键。以碱金属钠为例,它具有体心立方点阵,每一个钠原子共有14个近邻(8个近邻,6个次近邻),中间的钠原子只有一个未成对的价电子,不足以在所有相邻原子间形成共价键,只能轮流和周围的原子形成单电子结合及双电子结合的共价键,所以可以把它看作是未饱和的共价键。泡林认为,如果结合键作无序的分布,每一个原子平均只参与一个结合键,而电子在这些键中共振,也使电子能量降低,即晶体的稳定性提高。所以,金属键被认为是一个共振过程,金属的不同原子之间可以形成一个电子或两个电子共价结合的各种结构,而金属键就是在这所有不同结构之间的电子的共振。
早期认为金属的传导性是由于电子在金属晶体中能自由移动的缘故。这种说法有时会造成错误印象,因为金刚石等共价键晶体具有交换效应,它们的电子也是从一个原子到另一个原子连续运动,整个电子群也被认为是在晶体中连续循环的,但金刚石等却不具有导电性。所以泡林等认为绝缘体和导体之间的不同,不在于电子是否被束缚或能自由移动,而是在外电场作用下,晶体中的电子能否在给定的方向流动。由于导体具有未被填满的电子状态(或电子“轨道”),在外加电场的作用下,电子可以经未填满的电子状态而通过。因此,凡是每个原子具有较少价电子的元素,具有金属导电性。因为这些元素凝聚后,可利用的状态没有被填满,共价键未饱和,电子在外加电场作用下,可通过未被填满的“轨道”而运动。
应用金属共振结合的观点,虽然能够解释不少实验事实,如金属的导电性、导热性、过渡族金属的强度和磁性等,但是由于共振结构只是在实验数据分析的基础上提出的假设,没有直接的实验证明,因此现代金属结合理论普遍应用的是较严格的金属能带理论。金属能带理论不但对金属的电学性质有较好的解释,而且它所作的假设也比较少。
4.分子键
自由原子状态,已经形成稳定电子壳层的惰性气体He、Ne、Ar等和分子状态的H2、N2、O2等在低温时都能结合成液态或固态。在它们结合成液态或固态的过程中,并不给出或接受电子。这种存在于中性的原子或分子之间的结合力称为分子键,也称范德华(Van der Waals)力,它是一种长程作用力。
图2-15所示为两个中性的原子,它们具有球形对称的电子云。它们互相接近时,若处于图2-15a所示瞬时状态,则形成偶极子,原子之间有一引力;若处于图2-15b所示瞬时状态,则原子之间有一斥力。按照量子力学的观点,非极性分子(或原子)虽然本身偶极矩为零,但在运动的过程中,分子(或原子)上电子云分布的密度并不是始终均匀分布的,就每一个瞬间而言,由于电子云密度分布不均匀就产生了瞬时偶极矩,对靠近的非极性分子(或原子)的电子运动产生影响,形成偶极矩,因此发生相互作用而吸引。这就是范德华力。这种力很小,所以惰性气体的熔点和沸点都很低。
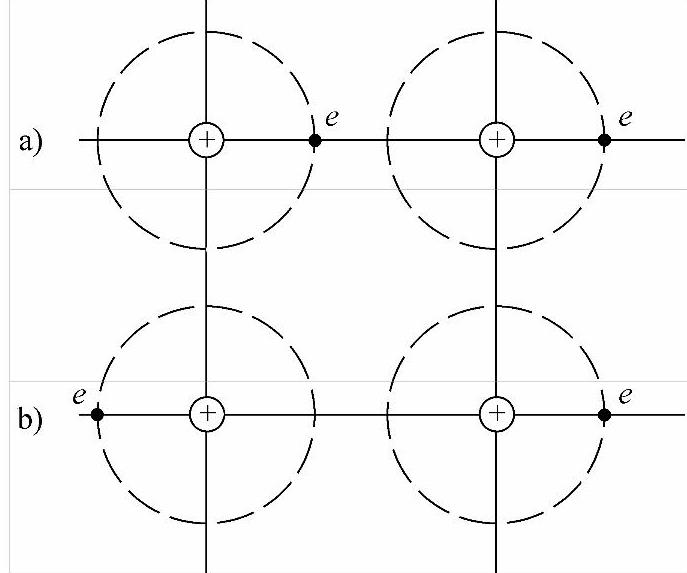
图2-15 瞬时的电子状态
液态或固态的H2、N2、O2也是靠范德华力进行凝聚的。它们的分子是靠共价键形成的。相邻的分子则由于电子互相协调运动而形成范德华力,一直到吸力和由于相邻分子的电子云重叠所产生的斥力相平衡为止。而石墨层的形成是由于其每个原子通过共价键与三个属于同一层的相邻原子相结合,每个原子的第四个电子形成金属键,为整个原子层所共有,但层间也是靠范德华力来结合的,所以层间结合较弱。
以上说明了在自由原子凝聚过程中,由于电子结构的变化,有四种不同的结合键及其相应的晶体。
在分子键晶体中,其原子的外层电子结构没有变化,如惰性气体。而其他三类结合键中,外层电子结构都发生了变化,有些原子给出了价电子。随着这些价电子被占有的方式的不同而分别形成三类不同的结合键晶体。在金属键晶体中,这些价电子为整个晶体所共有,例如单价金属,特别是碱金属;在共价键晶体中,这些价电子为邻近原子所共有,例如金刚石、硅、锗等;在离子键晶体中,这些价电子为其他原子所独占,例如碱金属和卤族元素形成NaCl、LiF等。事实上大多数晶体往往是以一种结合键为主,同时也综合有其他结合形式。
共价键晶体和离子键晶体的结合能约为105(J/mol)数量级;金属键晶体的结合能约为104(J/mol)数量级;分子键晶体的结合能约为103(J/mol)数量级。因此,共价键晶体和离子键晶体结合最强,金属键晶体次之,分子键晶体最弱。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




