在本节中将讨论最简单的原子——氢原子的问题。它的结果可以很方便地推广到类氢原子(如氘、氚、一次电离的氦He+、二次电离的锂Li++等等)的情况,它是了解复杂原子及分子结构的基础。
氢原子包含一个原子核和一个电子,由于原子核的质量比电子的质量大很多,可以近似地把原子核看成是静止的。又因为要研究的只是原子的内部状态,而不是它的整体运动,所以,只研究电子相对于原子核的运动就可以了。
1.氢原子的定态薛定谔方程
氢原子中的电子在原子核的库仑场中运动。原子核的电量为+e,电子的电量为-e,所以电子的势能为

式中,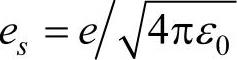 ;r为电子距原子核的距离;ε0为真空介电常数。那么电子的(亦即氢原子)定态薛定谔方程为
;r为电子距原子核的距离;ε0为真空介电常数。那么电子的(亦即氢原子)定态薛定谔方程为
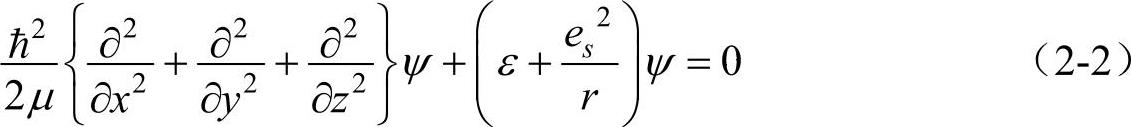
式中μ为电子与原子核的折合质量,μ=Mme/(M+me),M为原子核质量,me为电子质量。但由于原子核的质量比电子的质量大得多,因而,μ即为电子的质量me。ε为电子的总能量(势能与动能之和)。由于U(r)只是r的函数,所以式(2-2)用球坐标表示显然更方便,直角坐标与球坐标的空间关系如图2-1所示,两种坐标的关系式为
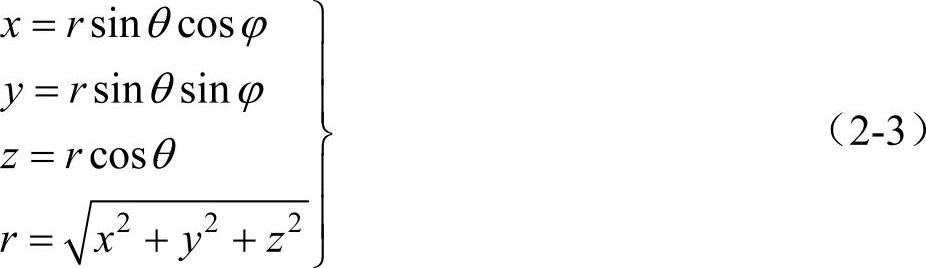
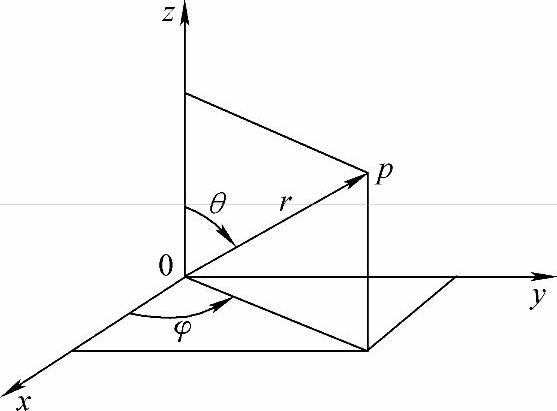
图2-1 直角坐标与球坐标的空间关系
在球坐标中,r的取值范围为0~+∞;θ的取值范围为0~π;φ的取值范围为0~2π。直角坐标系中描述的波函数ψ(x,y,z)可转变成用球坐标来描述ψ(r,θ,φ),式(2-2)化为球坐标方程为
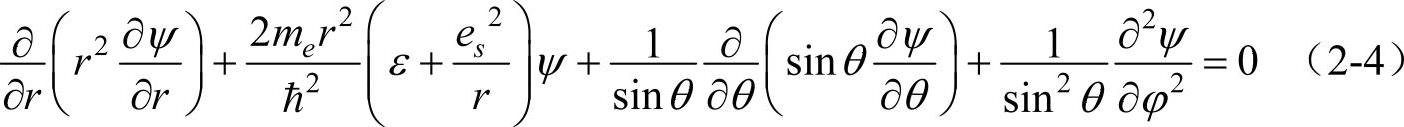
令ψ(r,θ,φ)=R(r)Y(θ,φ),将其代入式(2-4)中,再除以R(r)Y(θ,φ),便得到
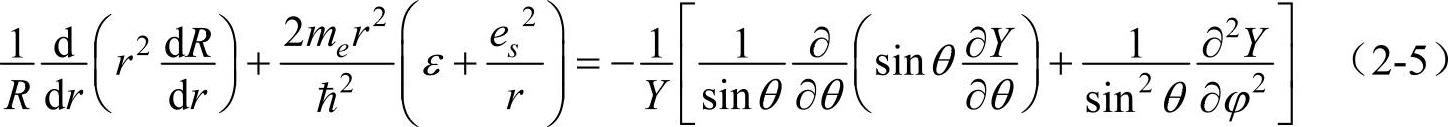
式(2-5)的左边只是r的函数,而右边只是θ和φ的函数。在这种情况下,要使
式(2-5)成立,它的两边必须等于同一个常数。设此常数为λ,则有
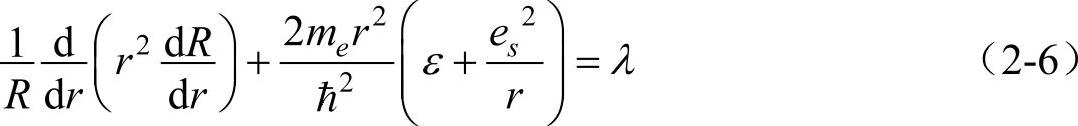
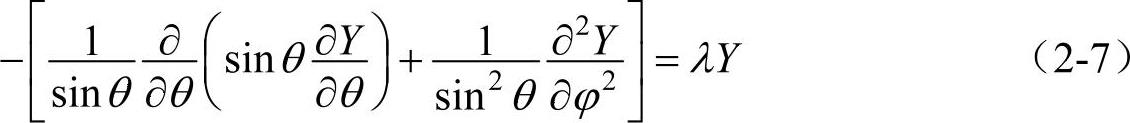
解式(2-6)和式(2-7)就可以求出氢原子波函数的角向部分Y(θ,φ)和径向部分R(r)。下面就分别求Y(θ,φ)和R(r)。
2.氢原子波函数的角向部分
欲求Y(θ,φ),需要解方程式(2-7)。以sin2θ乘式(2-7)的两边,可得
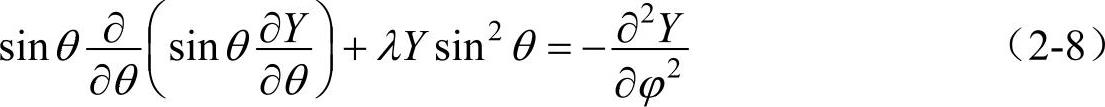
用分离变量的方法可以再将θ和φ分离。令Y(θ,φ)=Θ(θ)Φ(φ),并代入式(2-8)中,再除以Θ(θ)Φ(φ),就得到
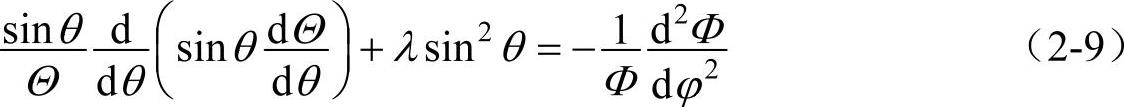
要使式(2-9)成立,它的左右两边也必须同时等于同一个常数。设这一常数为m2,则有
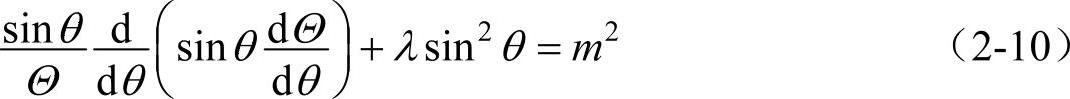
及

之所以将这一常数设为m2,是因为波函数的标准条件要求它必须为正值,如果取负值-k2,出现式(2-11)的解是Φ=Aekφ。这样,当φ=0,±2π,±4π,…时,Φ的值均不相等。而φ=0,±2π,±4π,…,指的是同一角度。这等于说,对于同一角度φ,Φ有不同的值,也就是说Φ不是φ的单值函数。这就违背了波函数的标准条件——单值性。因而对于式(2-9)所设的常数必须是正值。于是式(2-11)的解为Φ=Aeimφ,归一化后得到

为了使Φ是变量φ的单值函数,m必须是零或整数,即m=0,±1,±2,…。
以上求出了波函数角向部分中的Φ(φ)。下面再来求Θ(θ)。欲求Θ(θ),需要解方程式(2-10),即
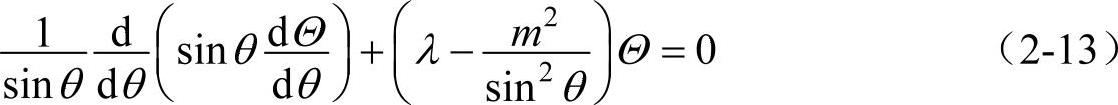
为了方便起见,可作变量代换,令x=cosθ,那么式(2-13)变为
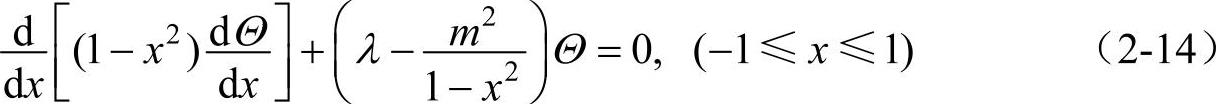
由式(2-14)的波函数的标准条件(单值性)要求,可得
λ=l(l+1)(l=0,1,2,…) (2-15)
满足式(2-15),方程式(2-14)的解为
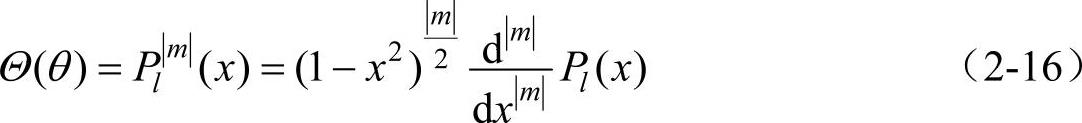
式中,Pl(x)是l阶勒让德多项式;Pl│m│(x)称为缔合勒让德多项式。它只有在│m│≤l时才不等于零,即│m│不能超过l,最大等于l。因而,对于一定的l值,m只能取下列(2l+1)个值。

将式(2-12)和式(2-16)代入Y(θ,φ)=Θ(θ)Φ(φ)中,便得到
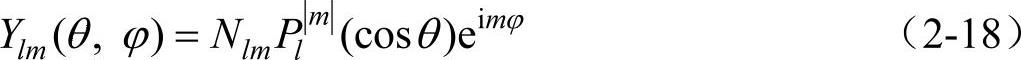
利用归一化条件
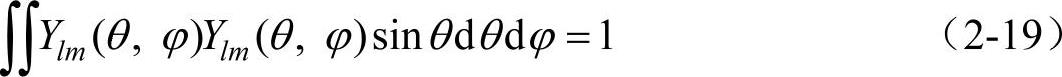
可求得

可见,只要给出l及m的值,即可求出相应的Ylm(θ,φ)。表2-1给出l=0,1,2这三种情况下氢原子波函数角向部分的具体形式。
表2-1 波函数角向部分的具体形式

3.氢原子波函数的径向部分
氢原子波函数的角向部分Ylm(θ,φ)只能告诉我们电子出现在某一方位的几率,也就是电子出现在θ→θ+dθ和φ→φ+dφ的立体角内的几率的大小,要想知道电子出现在距原子核不同距离处的几率的大小,必须求氢原子波函数的径向部分R(r),这就需要解方程式(2-6)。(https://www.xing528.com)
方程式(2-6)可以改写成
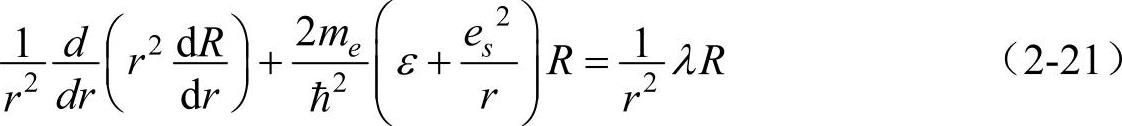
将式(2-15)代入式(2-20),即得
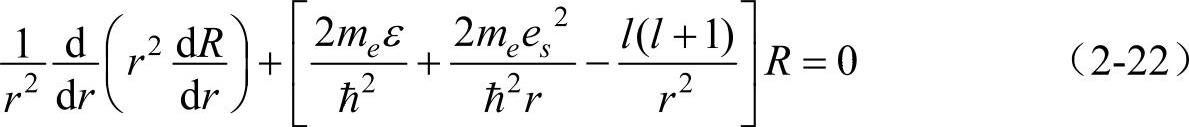
当能量为正值时(ε>0),无论ε等于任何值,式(2-22)的解都满足波函数的标准条件,即体系的能量具有连续谱,在无穷远处波函数不为零。能量为正值意味着电子不再受原子核的约束,这对应于电离状态的电子。换句话说,当电子电离后其能量是连续可变的。然而当能量为负值时,我们看到,电子受到原子核的束缚,这时只有当ε取下列特定值时,方程式(2-22)的解才满足波函数的标准条件。
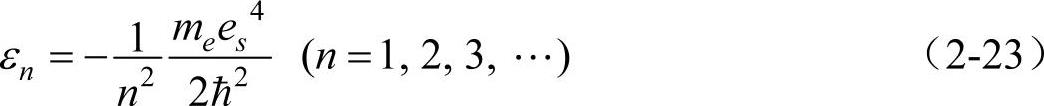
在能量满足式(2-23)条件下,方程式(2-22)的解为
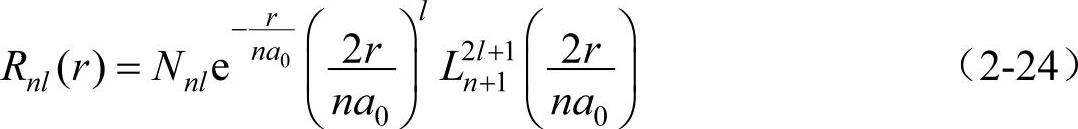
其中a0=ћ2/(mees2)恰好是氢原子的第一玻尔轨道半径,Nnl是归一化因子。利用归一化条件

式中,Rn*l(r)为Rnl(r)的共轭复数。由式(2-25)可以得到
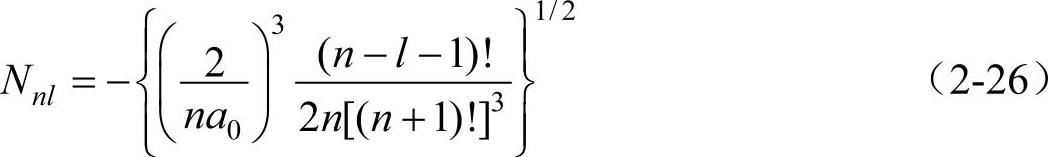
将式(2-26)代入(2-24)可得
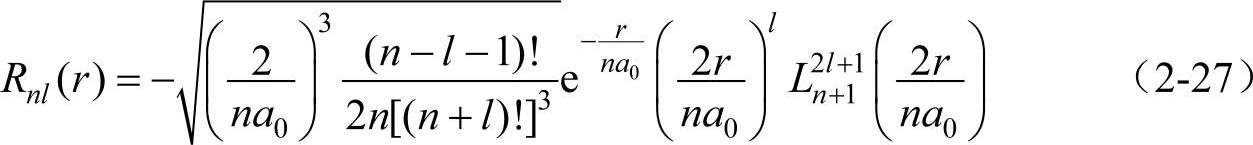
其中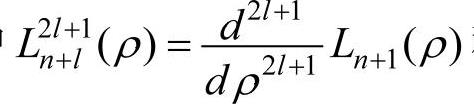 称为缔合拉盖尔多项式。量子数l的最小值为零,最大值为(n-1),即l=0,1,2,…,(n-1)。一般称l=0的态为s态,l=1,2,3…的态依次称为p,d,f…态,处于这些态的电子,依次称为s,p,d,f…电子。当n和l取不同值时,氢原子的径向波函数将有不同的形式。表2-2给出n=1,2,3三种情况下的径向波函数。
称为缔合拉盖尔多项式。量子数l的最小值为零,最大值为(n-1),即l=0,1,2,…,(n-1)。一般称l=0的态为s态,l=1,2,3…的态依次称为p,d,f…态,处于这些态的电子,依次称为s,p,d,f…电子。当n和l取不同值时,氢原子的径向波函数将有不同的形式。表2-2给出n=1,2,3三种情况下的径向波函数。
表2-2 径向波函数的具体形式

归纳上述内容可以得到氢原子的定态波函数为
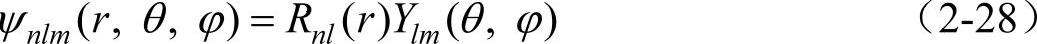
它是由量子数所表征的。这三个量子数的值分别为
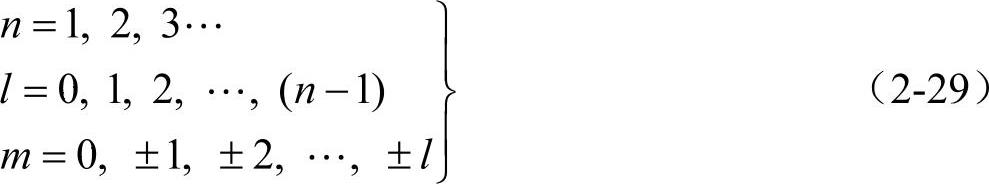
薛定谔方程解中的量子数有十分明确的物理意义。n为主量子数,它决定着电子运动状态的能量(负值),在氢原子或类氢离子体系中,n相同的电子具有相同的能量。n与能层或电子层相对应,n=0,1,2,…分别称电子处于第一、二、三、…能层,常用光谱符号K,L,M,N,…分别表示;l为角量子数,由l决定电子运动角动量的大小而得名,它决定了电子在空间的角度分布与电子云的形状。在多电子体系中l还影响电子的能量。l决定着同一层中能级的大小,因而常称为副量子数。l取值为0,1,2,…,(n-1)分别可用相应的光谱符号s,p,d,f,…等来标记;m为磁量子数,角量子数为l的电子在外磁场中有不同的取向。它在磁场方向上的分量由m决定。
4.氢原子核外电子的几率分布
氢原子问题实质上是氢原子的核外电子相对于核的运动问题。Ψnlm(r,θ,φ)=Rnl(r)Ylm(θ,φ)是描写氢原子中电子运动的波函数。因此,氢原子中电子处在核外某体积元dτ(图2-2)中的几率为
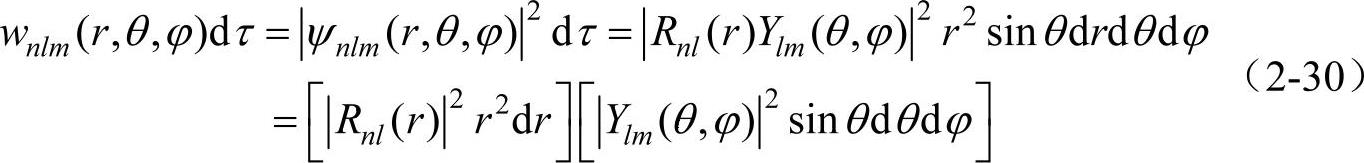
上式中的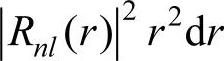 表示在半径为r到r+dr的球壳内找到电子的几率;而
表示在半径为r到r+dr的球壳内找到电子的几率;而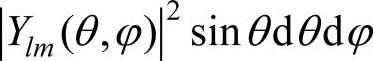 则表示在立体角dΩ=sinθdθdφ内找到电子的几率,或者说是限定在θ→θ+dθ和φ→φ+dφ范围内找到电子的几率。
则表示在立体角dΩ=sinθdθdφ内找到电子的几率,或者说是限定在θ→θ+dθ和φ→φ+dφ范围内找到电子的几率。
从表2-2可以看出,径向波函数既决定于量子数n,也决定于量子数l。在半径为r至r+dr的球壳内找到电子的几率为

根据这一关系式就可画出如图2-3所示电子径向几率分布。
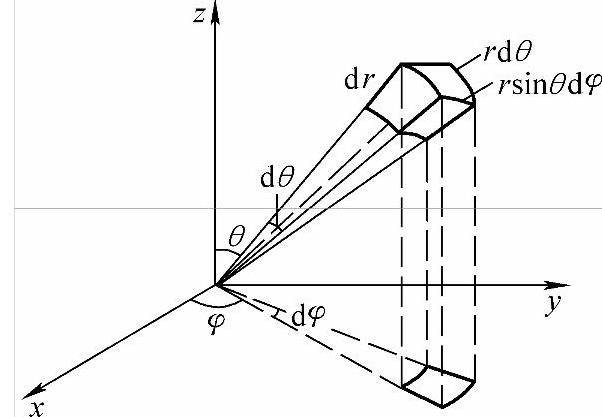
图2-2 氢原子核外体积元
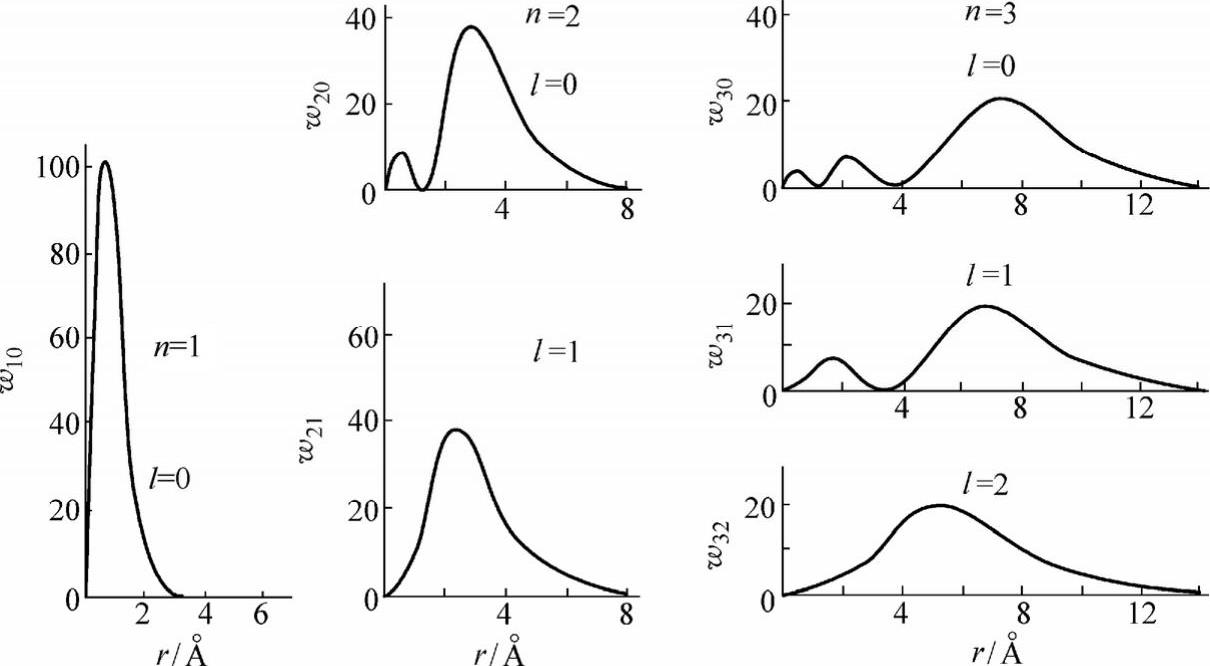
图2-3 氢原子中电子径向几率分布(1Å=0.1nm)
对于1s态的电子(n=1,l=0),有
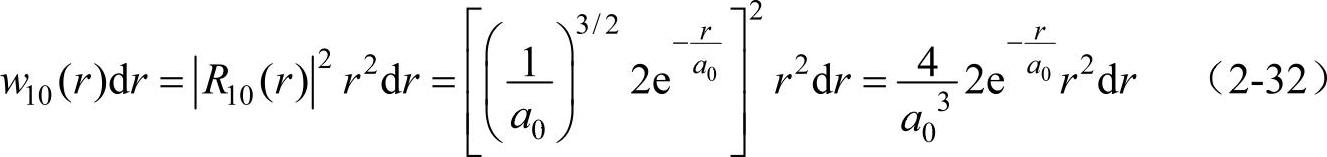
对于2s态的电子(n=2,l=0),有
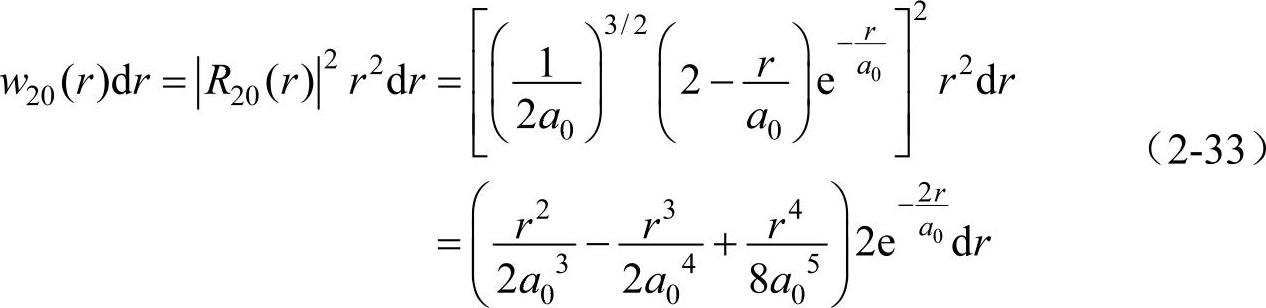
可以证明w10(r)的最大值在r=a0处(a0为玻尔第一轨道半径),且在r=0及r=∞处w10(r)=0。这说明,在r=0和r=∞除外的其余空间中找到电子的几率均不为零。(注意,这是指径向分布,尚未考虑角向分布)。在r=a0附近找到电子的几率最大。同样可以得到2p态和3d态电子的径向几率密度的最大值分别是在r=4a0和r=9a0处。
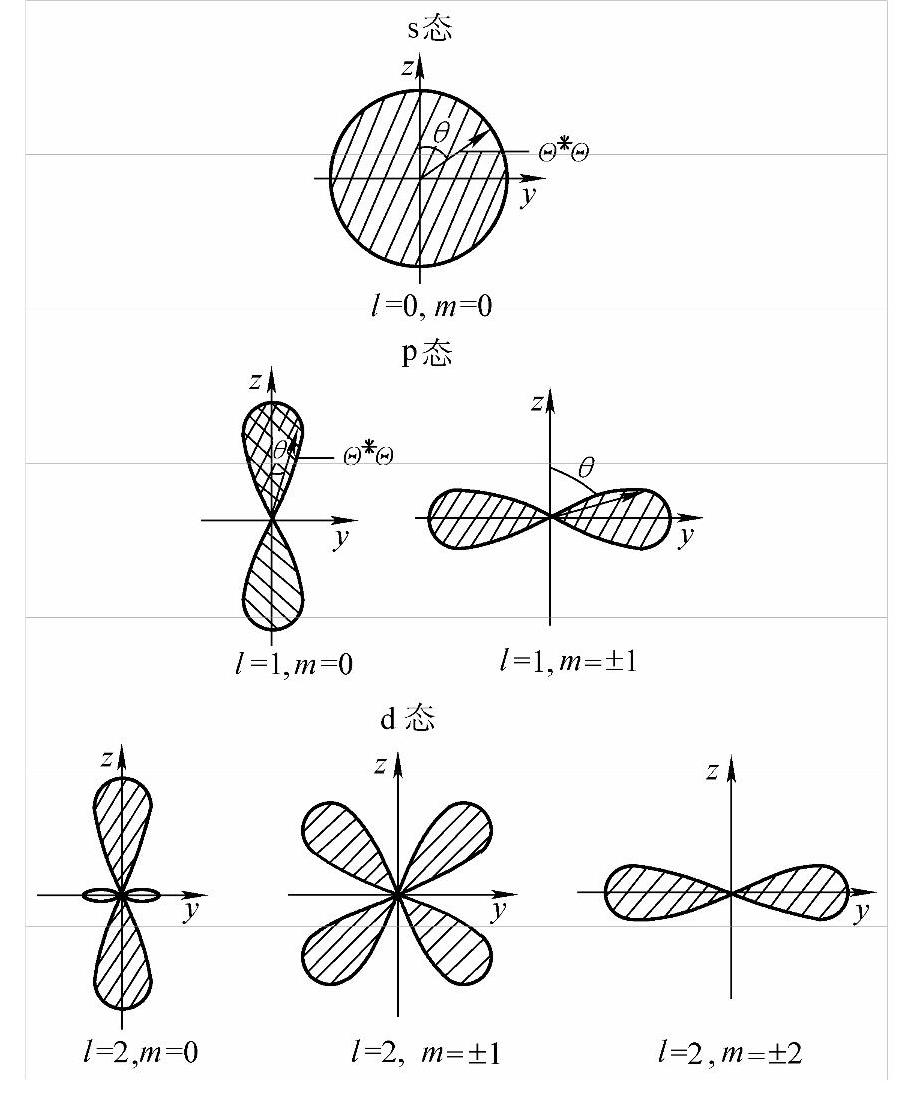
图2-4 电子角向几率分布
至于氢原子中的电子按角度的分布,由于电子位于立体角dΩ内的几率为
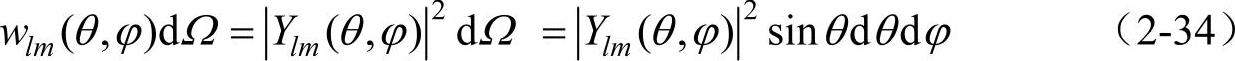
因此表2-1已给出几个态的Ylm(θ,φ)的具体形式,利用该表即可画出s态(l=0),p态(l=1)和d态(l=2)电子的几率按角度的分布,如图2-4所示。图中给出的是几率与θ角的关系。对于与竖直轴的夹角为θ的某一射线来说,阴影所截取射线的长度即表示与该θ角相对应的几率。至于Ylm(θ,φ)与φ的关系,由于Ylm(θ,φ)中与φ有关的因子是eimφ,故│Ylm(θ,φ)│2与φ无关。于是几率按角度的分布图就是将图2-4中的每一个小图形分别绕竖直轴旋转半周所得到的立体图形。
原子轨函Ψ的径向和角度分布图只表明Ψ数值在空间的变化,不表明电子运动的轨迹。若要形象地理解原子轨函,应该用电子云图——│Ψ│2在空间的分布,即电子在空间出现的几率密度的分布图。综合│R│2-r图与│Y│2-θ,φ图,常用小黑点的密疏来表示│Ψ│2在空间的大小,如图2-5a所示。有时用等密度线的方式,以最密处定为l,其他各面注以相对密度值,如图2-5b所示。也可用界面由来表示,此时所画出的界面表明在此界面内电子出现的几率达到90%,如图2-5c所示。
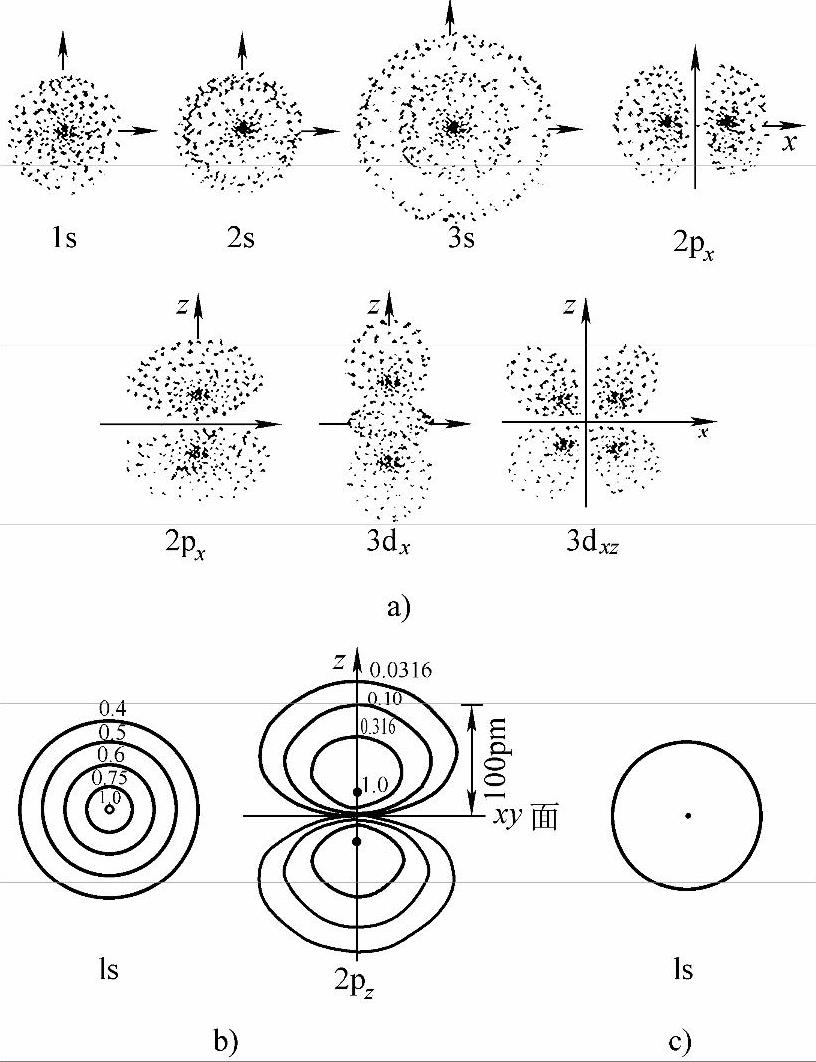
图2-5 电子云图像的几种方式
a)电子密疏图 b)等密度图 c)界面图
5.氢原子中电子能量
前面已导出氢原子中电子的能量为式(2-23),式(2-23)说明氢原子中电子的能量只能取一系列分立值。能级从基态-mees4/(2ћ2)起一直延伸到零,而且愈来愈密。这是由于库仑势的绝对值随r增大而缓慢减小的缘故。
n值确定之后,电子的能量也就确定了,然而,对于一个确定的n值,电子的波函数还可以有不同的形式。这是由于波函数Ψnlm(r,θ,φ)与n,l,m有关。这一点在表2-1及表2-2中表示得很清楚。从表中可以看出:对于一个给定的n值,l可以取0,1,2,…,(n-1);而对于一个给定的l值,m又可以取(2l+1)个不同的值。可见,对应于一个能级可以有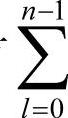 ∑(2l+1)=n2个状态。因此,我们说氢原子中电子的能级是简并的。第n个能级的简并度等于n2。例如,当n=3时,氢原子中电子有一个能级,而波函数却有9种,它们是:Ψ300、Ψ311、Ψ310、Ψ31-1、Ψ322、Ψ321、Ψ320、Ψ32-1、Ψ32-2。
∑(2l+1)=n2个状态。因此,我们说氢原子中电子的能级是简并的。第n个能级的简并度等于n2。例如,当n=3时,氢原子中电子有一个能级,而波函数却有9种,它们是:Ψ300、Ψ311、Ψ310、Ψ31-1、Ψ322、Ψ321、Ψ320、Ψ32-1、Ψ32-2。
本节所讨论的关于氢原子的性质,可以很方便地推广到类氢离子以及在有心力场中运动的粒子。对于类氢离子来说,它的原子核的电量是Ze,这使得它的势能不再是U(r)=-e2/(4πε0r),而是U(r)=-Ze2/(4πε0r)。这一差别与波函数的角向部分无关,它只对径向波函数有影响。而且只需将氢原子的径向波函数中的1/a0换成Z/a0即可。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




