【高考化学·考试大纲】微粒间的相互作用与物质的性质:(1)理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。(2)了解共价键的形成、极性、类型(σ键和π键);了解配位键的含义。(3)能用键能、键长、键角等说明简单分子的某些性质。
【课程标准·学业要求】(1)能说出微粒间作用(离子键、共价键、配位键和分子间作用力等)的主要类型、特征和实质。(2)能比较不同类型的微粒间作用的联系与区别。(3)能说明典型物质的成键类型。(4)能利用电负性判断共价键的极性。(5)能从微粒的空间排布及其相互作用的角度对生产、生活、科学研究中的简单案例进行分析,举例说明物质结构研究的应用价值,如配合物在生物、化学等领域的广泛应用。
1.共价键的形成与类型
(1)[17 全国Ⅲ,35]Mn(NO3)2中的化学键除了σ键外,还存在__________________。
(2)[16 全国I,37]Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是______________________________________________________。
(3)[15 全国Ⅰ,37]碳在形成化合物时,其键型以共价键为主,原因是_______________________________________________________________________。
(4)[14 全国Ⅰ,37]1mol乙醛分子中含有的σ键的数目为______。
2.键能的计算:[18 全国I,35]Li2O是离子晶体,其晶格能可通过下图的Born-Haber循环计算得到。
可知,O=O键键能为kJ·mol-1。
3.配位键与配合物
(1)[16全国II,37]在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为_______,提供孤电子对的成键原子是_________。
(2)[全国高考Ⅱ]化合物K3FeF6中,化学键的类型有______________;该化合物中存在一个复杂离子,该离子的化学式为________,配体是_____。
4.[14 全国Ⅱ,37]H、N、O、S、Cu这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如右图)。该化合物中,阴离子为_____________,阳离子中存在的化学键类型有______________;该化合物加热时首先失去的组分是_______,判断理由是_____________________________。
一、化学键的分类
二、共价键的三参数
三、共价键的类型
(1)σ键:由两个相同或不相同的原子轨道沿轨道对称轴方向“头碰头”相互重叠而形成的共价键。σ键有方向性,两端的原子可以沿轴旋转。
(2)π键:两个原子的p轨道从垂直于成键原子的核间联线的方向“肩并肩”接近,发生电子云重叠而形成的共价键。π键两端的原子不能沿轴旋转。
四、配合物的基础知识
1.配位键
成键的两个原子一方提供_______,一方提供_______而形成的共价键。其中,提供孤电子对的分子或离子称为配体,配体中提供孤电子对的原子称为配位原子。
2.配位数
配体的数目(多数为中心离子电荷数的2倍)。
3.配合物
由提供孤电子对的_______与接受孤电子对的______(或_____)以____键形成的化合物称配合物。
[Cu(NH3)4]SO4中几个概念的图示如下:
4.配合物成键条件
(1)中心原子(或离子)必须存在空轨道。
(2)配体具有提供孤电子对的原子、分子或离子。
5.配位键的表示
中心原子(或离子)←配体,如在NH+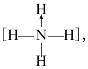
4中,虽然有一个N-H键形成过程与其他3个N-H键形成过程不同,但是一旦形成之后,4个共价键就完全相同。
6.配合物的性质
配合物具有一定的稳定性,配合物中配位键越强,配合物越_____,当作为中心原子的金属离子相同时,配合物的稳定性与配体的性质有关。(https://www.xing528.com)
【考型1】共价键的形成及稳定性
1.[全国高考Ⅰ]碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
(1)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是____________________________________________________________________________________________________________。
(2)SiH4的稳定性小于CH4,更易生成氧化物,原因是___________________________________________________________________________________。
【考型2】σ键和π键
2-1.[14 海南,19]石墨晶体中,层内C-C键的键长为142pm,而金刚石中C-C键的键长为154pm。其原因是金刚石中只存在C-C间的____共价键,而石墨层内的C-C间不仅存在____共价键,还有____键。
2-2.[15 江苏,21]1molCH3COOH中含有σ键mol。
【考型3】配位键与配合物
3-1.[山东高考]若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物中提供孤对电子的原子是______。
3-2.[16 江苏,21][Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_________________。
【考型4】*大Π键
4.[17 全国Ⅱ,35]N5-![]() 阴离子中的σ键总数为_____个。分子中的大π键可用符号Πnm表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π66),则N-5中的大π键应表示为___________。
阴离子中的σ键总数为_____个。分子中的大π键可用符号Πnm表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π66),则N-5中的大π键应表示为___________。
一、共价键的形成及稳定性
(1)键长越短,键能越大,越稳定,键合时倾向于形成更稳定的共价键。例如稳定性C-C键>Si-Si键。
(2)一般键角为109°28´(正四面体结构)比较稳定,键角变小,键的张力变大,稳定性降低,所以白磷(P4)(正四面体结构)较活泼。
(3)碳原子(ⅣA)最外层有4个价电子,且半径较小,反应中既不容易完全失去电子也不容易完全得到电子形成稳定电子层结构,一般通过与非金属元素形成共价键的方式键合。
二、σ键和π键的成键特点
两原子键合时,首先以原子轨道“头碰头”的重叠方式形成σ键,σ键重叠程度大,键能大。两原子键合时,首先形成并且只能形成一个σ键(σ键有s-s,s-p,p-p等几种重叠方式)。如果σ键较短,两原子间还能以p-p轨道“肩碰肩”的方式重叠形成π键,但是如果σ键较长,p-p轨道难于进行“肩并肩”重叠形成π键。所以,容易形成C=C和CO2(O=C=O),但是难于形成Si=Si和SiO2分子,而容易形成硅晶体(Si-Si的四面体)和SiO2原子晶体(Si-O的四面体)。
共价双键有一个σ键和一个π键,共价三键有一个σ键和两个π键。
一般π键较σ键键能小,在反应中,首先断裂的是π键(如加成反应);共价双键比单键的键长短,键能大。
三、配位键与配合物
(1)配位键多为σ键,一般比化学键弱,配位键的空间构型可用类似价层电子对互斥理论分析。
①常考的中心原子(或离子):①缺电子的中心原子:BCl3中的B;Al(OH)3、AlCl3中的Al;②过渡元素的离子:Fe3+、Zn2+、Ag+、Cu2+、Cr3+、Ni2+等。
②常见能提供孤电子对的原子:①单配位原子H2O中的O;NH3中的N;CO中的O;CN-中的C;F-和Cl-等。②多配位原子。H2NCH2CH2NH2(乙二胺)两个N原子都可以提供孤电子对。这时配合物可能形成环状或笼状复杂结构。
(3)常见存在配位键的微粒:[Cu(NH3)4]SO4、H3O+、NH+4、BH4-、BF4-、[Al(OH)4]-、(AlCl3)2(或Al2Cl6)、(FeCl3)2(或Fe2Cl6)、K3[FeF6]、Ni(CO)4、NH4BF4、BCl3·NCl3[Cl3B←NCl3]、CO等。
(2)多数结晶水合物中存在配位键和分子间作用力。例如五水合硫酸铜[Cu(H2O)4]SO4·H2O,前4个水分子是配位键,后面一个水分子是分子间作用力或者氢键。
(3)配位化合物离子常表示为:[中心原子(配位体)n]m±,例如[Cu(NH3)4]2+。写离子方程式时,配合离子不拆分。
(4)配位键的形成增加了物质的稳定性,可以用化学平衡原理来分析平衡的移动。如电镀厂电镀银时需要降低镀层金属的沉积速度,加入NaCN能够生成稳定的络合物[Ag(CN)2]-,降低Ag+的浓度,有利于镀层金属致密。
5.缺电子物质与多聚分子。AlCl3属于缺电子物质,Al有空轨道,能接受另一个分子中Cl的孤电子对形成配位键,得到双聚分子Al2Cl6,结构式为![]() 与之类似的有(FeCl3)2。
与之类似的有(FeCl3)2。
四、*大π键(属于信息拓展运用)
大π键:多原子在同一平面形成共价键时,如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为大π键(或离域π键,或共轭大π键)。
通常用Πnm表示,其中m代表参与形成大π键的原子数(或平行的p轨道的数目),n代表参与形成大π键的电子数。例如:①苯分子中的6个碳原子以sp2杂化形成环,碳原子还各有一个未杂化的p轨道并相互平行。这6个平行p轨道(m)总共6个电子(n)在一起,形成了弥散在苯环的6个碳原子上下的一个p-p离域大π键,符号Π66。②与上类似,石墨分子结构是层形结构,每层是由无限个碳六元环所形成的平面。其中,每个碳原子均以sp2杂化,余下一个未杂化的p轨道相互平行,n个p轨道形成了一个p-p大π键,n个电子弥散在整个层的n个碳原子形成的大π键里,电子在这个大Πnn键中可以自由移动,所以石墨能导电。
以下结构中也含有大π键:1,3-丁二烯分子(Π44)、![]()
![]()
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




