全基因组研究发现IBD和反映肠道微生态异常免疫反应的基因有关。一项超过75 000个样本量的大规模遗传学研究发现了163个与IBD相关的宿主易感基因位点,这些基因位点富含于与环境因素调节肠道内稳态有关的信号通路中(Jostins et al,2012)。如SLC39A8突变与CD相关,且在突变体样本的肠道黏膜中发现有肠道菌群的改变(Li et al,2016)。因此,遗传因素在IBD的发病机制中起到一定作用,且这些作用可能与肠道微生态相关。
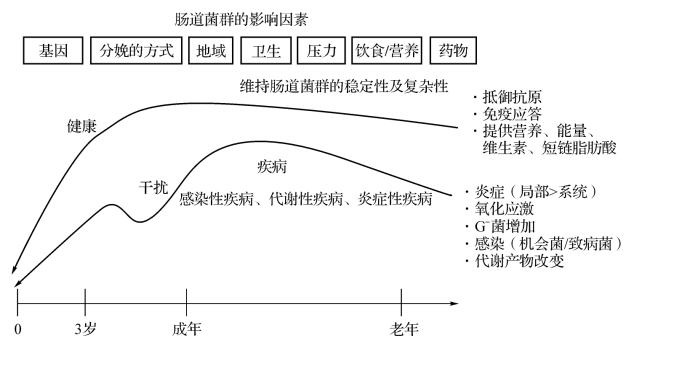
图11-1 健康和患病个体中影响肠道微生物稳定性和复杂性的因素。在人出生后的不同时期,微生物组的关键特性(包括稳定性、恢复力和复杂性)被各种因素影响,例如基因、饮食、药物以及其他因素。这些因素可干扰微生物的复杂性和稳定性,从而可能导致微生态失调。例如,由于各种因素干扰导致机体产生氧化、应激、炎症、代谢产物变化等,而这些环境因素变化可导致革兰阴性菌增加,改变微生物组成。而在健康个体的肠道中,这些特性有助于维持肠道的生理功能,例如抵抗致病菌、激活免疫功能以及消化食物来提供能量和营养(包括维生素和SCFA)。(https://www.xing528.com)
基因与肠道微生物间可能通过免疫系统发挥作用。首个被发现的CD易感基因是NOD2,它可以识别胞壁酰二肽(一种革兰阳性和革兰阴性菌细胞壁上的肽聚糖成分)从而刺激免疫反应。NOD2在潘氏细胞中表达,而潘氏细胞主要位于回肠末端的肠隐窝底部。因此,不难想象NOD2突变可能会对微生物环境的组成造成显著影响。携带NOD2突变基因的IBD病人的黏膜黏附细菌数量增加,同时抗炎因子白介素10的转录减少。而在携带有NOD2和ATG16L1(一种IBD易感基因,参与自噬)突变基因的IBD病人中,他们的肠道微生物结构有明显改变,包括柔嫩梭菌(Faecalibacterium)数量减少,埃希杆菌(Escherichia)数量增加。此外,FUT2基因也对微生物组成造成影响。功能缺失的等位基因FUT2的纯合子是“非分泌者”,它在胃肠道黏膜和身体排泄物中不表达ABO抗原。而“非分泌者”可增加CD的患病风险,同时其黏膜相关微生物也发生显著改变。因此,宿主基因在肠道微生物的建立和塑型上有着重要作用。同卵双生子较非双胞胎的兄弟姐妹确实有着更相似的微生物组。然而,同卵双生子间IBD的一致率明显低于50%,其中CD的一致率最低。因此,除了遗传因素外,一些环境因素也和IBD有关。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




