化学平衡是一定条件下相对的、暂时的平衡,当条件发生变化时,平衡会被打破,被破坏的平衡会建立起适应新条件的新的平衡。因外界条件的改变,体系由一个平衡状态变到另一个平衡状态的过程称为化学平衡的移动。
1.浓度对化学平衡移动的影响
当可逆反应达到平衡后,若保持其他条件不变,改变任一反应物或生成物的浓度,都可使正、逆反应速率不再相等,造成化学平衡发生移动。
把可逆反应在任意时刻生成物的浓度方次之积与反应物浓度方次之积的比值,称为反应商或浓度商(各浓度的方次数等于化学反应方程式中各物质的化学计量系数),用符号“Qc”表示。对任一可逆反应,有
上式中的各物质浓度表示的是A、B、C、D 在任意状态下的浓度。反应商与平衡常数的数学表达式相同,但含义不同:反应商表达式中的浓度是各物质任意状态下的浓度,其值不定,且可以是反应进行到任意时刻时的数值;而平衡常数表达式中各物质的浓度指的是平衡状态下的浓度,只要平衡的条件一定,其值不变。
通过比较Qc和Kθc 的相对大小,不但可以判断可逆反应是否已经达到最大反应限度(即平衡状态),还可判断体系处于非平衡状态时,可逆反应进行的方向。基本规则如下:
当Qc=Kθ
c 时,体系处于平衡状态(可逆反应达到最大限度);
当Qc<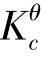 时,体系处于非平衡状态,反应将向正方向进行,直至Qc=Kθc;
时,体系处于非平衡状态,反应将向正方向进行,直至Qc=Kθc;
当Qc> 时,体系处于非平衡状态,反应将向逆方向进行,直至Qc=Kθc。
时,体系处于非平衡状态,反应将向逆方向进行,直至Qc=Kθc。
因此,当其他条件不变时,增加反应物浓度或减少生成物浓度,化学平衡向正方向(向右)移动;增加生成物浓度或减少反应物浓度,化学平衡向逆方向(向左)移动。
2.压力对化学平衡移动的影响
可逆反应虽有气体参加,但反应前后气体分子总数相等,改变压强,平衡不移动。
对有气体参加且反应前后气体分子数不相等的可逆反应,保持其他条件不变,改变平衡体系的压强,容器的体积发生改变,则气体反应物和生成物的浓度将会发生改变,化学平衡会发生移动。压强对化学平衡移动的影响实质上与浓度对平衡移动的影响相一致,平衡移动的方向取决于反应前后气体分子总数的变化。
通过大量的实验事实得出结论:在其他条件不变的情况下,增大压强,化学平衡向气体分子总数减少的方向移动;减小压强,化学平衡向气体分子总数增加的方向移动。
如向体系中加入惰性气体,若体积不变,系统的总压力增加,但各反应物和生成物的分压不变,Qp= ,平衡不移动;若保持总压不变,则系统的体积增大,各反应物和生成物的分压相应减小,则Qp≠
,平衡不移动;若保持总压不变,则系统的体积增大,各反应物和生成物的分压相应减小,则Qp≠ ,则平衡向气体分子数增多的方向移动。
,则平衡向气体分子数增多的方向移动。
3.温度对化学平衡移动的影响
在一定温度下,浓度或压力的改变并不引起平衡常数K 值的改变。温度对化学平衡移动的影响则不然,温度的改变会引起平衡常数的改变,从而使化学平衡发生移动。
对吸热反应,![]() ,升高温度,K 将增大;降低温度,K 将减小。而对放热反应,
,升高温度,K 将增大;降低温度,K 将减小。而对放热反应,![]() ,升高温度,K 将减小;降低温度,K 将增大。
,升高温度,K 将减小;降低温度,K 将增大。
温度对化学平衡的影响可以归纳为:在其他条件不变的情况下,升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。(https://www.xing528.com)
吕·查德里(Le Chatelier)原理:向一平衡体系施加外力时,平衡将会向着减少此外来影响的方向移动。
4.催化剂对化学平衡的影响
催化剂只改变反应的活化能Ea,不改变反应的热效应,不影响平衡常数,即催化剂只能改变平衡到达的时间而不能使化学平衡移动。
5.化学平衡移动的计算
【例题3.10】在763 K 时,反应![]() 。将H2和I2在该温度下按下表初始浓度混合,反应各向哪个方向自发进行?
。将H2和I2在该温度下按下表初始浓度混合,反应各向哪个方向自发进行?
解:浓度编号a 中因为
所以反应自发逆向进行。
浓度编号b 中因为
所以反应自发正向进行。
浓度编号c 中因为
所以反应达成平衡状态。
【例题3.11】对于反应![]() ,已知在308 K 时,
,已知在308 K 时, =1.0,求:
=1.0,求:
(1)将0.30 mol CO、0.30 mol H2O、0.10 mol H2和0.10 mol CO2装入1 L 的密闭容器中,使之在该温度下反应,判断反应进行的方向和达到平衡时CO 的平衡转化率αCO;
(2)在上述(1)的平衡体系中保持其他条件不变,使水蒸气的浓度增大到0.30 mol·L-1,达到平衡时CO 的总转化率αCO。
所以 反应正向进行。
设平衡时CO 反应了x mol·L-1,则有
(2)设加入水蒸气到达平衡状态时CO 反应了y mol·L-1,则有
【例题3.12】已知反应![]() 在873 K 时,
在873 K 时,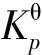 =0.178,当总压力为101.3 kPa 时,将乙苯与水蒸气(不参加反应)按分子数1∶9 混合,求乙苯的平衡转化率αC6H5C2H5。
=0.178,当总压力为101.3 kPa 时,将乙苯与水蒸气(不参加反应)按分子数1∶9 混合,求乙苯的平衡转化率αC6H5C2H5。
在总压力一定时,向体系中加入不参加反应的气体,相当于降低气体反应物的分压,平衡向气体分子总数增多的方向移动,对于上述乙苯的分解反应,加入水蒸气能使乙苯有较大的平衡转化率。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




