传统的产前诊断技术是指通过侵入性的检查方法,获取胎儿遗传样本,在专业实验室诊断胎儿是否患有遗传性疾病。近年,随着影像学技术的快速发展,超声检查在产前诊断中的作用越来越大,大部分结构畸形的胎儿可以通过产前超声诊断,而且一部分遗传缺陷的胎儿也能被早期超声发现,这方面内容在本章中有另节叙述。本节仍重点介绍传统的侵入性产前诊断技术。
一、产前诊断的范畴
人类的疾病种类繁多,并不是任何一种疾病都适合产前诊断。目前,产前诊断的疾病范围为危害严重的遗传病或先天缺陷,主要包括以下部分。
(一)单基因病
单基因病是指由一对基因决定的遗传病,通常严格遵循孟德尔法则传递。突变基因可在常染色体上或性染色体上,呈显性或呈隐性;依据致病基因所在的染色体和显性、隐性关系,可有4种遗传方式:常染色体显性遗传、常染色体隐性遗传、X连锁显性遗传和X连锁隐性遗传。目前已经明确的单基因遗传病有2 000多种,新生儿总发病率为1%,单基因病的发病率存在人群差异。由于单基因病的基因型和表型关系明确,最适宜于产前诊断。
(二)染色体病
染色体数目和结构异常所引起的疾病称染色体病。目前已经得知的染色体病有300余种,大多数伴有生长发育迟缓,智力低下、畸形、性发育障碍等多种先天缺陷。唐氏综合征是最常见的染色体病。
(三)先天性结构畸形
这类疾病多由遗传因素和环境因素共同作用所致。我国的先天畸形以神经管缺陷发病率最高。此外,常见的先天畸形还有唇腭裂、肢体畸形、先天性心脏病等。以上疾病在孕期通过超声检查可以产前诊断。
二、实施产前诊断的必要条件
产前诊断不是一般的疾病诊断,它涉及遗传咨询、风险评估、侵入性诊断技术、流产或终止妊娠可能,会给孕妇及家庭造成精神压力和一系列伦理问题。因此,实施产前诊断必须满足一定的条件。
1.所要诊断的疾病为致死性或严重的智力或身体残疾,足以需要终止妊娠。
2.所要诊断的疾病无治疗方法,或治疗不彻底或特别昂贵。
3.在实施产前诊断前,应确定患者接受终止妊娠的选择。在某些情况下,有些患者不接受终止妊娠,应尽量避免侵入性诊断。
4.在实施侵入性诊断前,应与患者详细讨论胎儿患病的风险及技术操作的风险。永远由患者决定是否接受侵入性诊断。
5.家族中出生过患者而要求产前诊断时,在行侵入性检查之前一定要确诊患者和父母(携带者)。
6.对所要诊断的疾病要有可靠有效的诊断方法。
7.要有合格的临床操作技术和实验室诊断技术。
8.对产前诊断结果异常者,要有后续的临床处理能力。
三、产前诊断的具体适应证
产前诊断技术对胎儿有流产的风险,在临床应用上要有明确的适应证。
(一)检测染色体异常
1.产前唐氏综合征筛查高风险,为最常见指征。
2.胎儿超声检查出现软指标或结构性畸形,染色体病风险增加。
3.既往生育过染色体异常儿,如21-三体,18-三体等。
4.夫妇之一是染色体平衡易位、倒位者或其他异常携带者。
5.高龄孕妇,一般指35岁以上。但单纯以年龄为产前诊断指征者在产前筛查普及后已显著减少。
(二)检测非染色体遗传性疾病
有生育严重遗传病患儿的风险,如珠蛋白生成障碍性贫血(地中海贫血)、血友病、遗传代谢病等,需要胎儿样本行分子或生化检查。
四、介入性产前诊断手术
1968年,Mohr首先提出使用绒毛活检产前诊断遗传病这一概念,他在直径5mm的内镜指示下经宫颈活检绒毛,成功率96%,但出血、感染、培养失败等发生率高。首次真正用于诊断目的的绒毛活检术出现于1975年,中国鞍山市鞍钢医院妇产科用此种方法进行性别鉴定。该研究发表于第一期中华医学杂志,在100例早孕妇女中采用盲吸法,先从宫颈伸入内径3mm金属导管,当遇软组织阻力时,将更细的内管置入,外端接注射器吸引;采样成功99例,错误诊断6例,引起流产4例。直到1984年,Smidt-Jensen等首次报道超声下经腹绒毛穿刺技术,因感染率更低、可反复抽吸使此技术迅速流行。因绒毛穿刺在妊娠早期进行,对异常妊娠可早期处理,因此是较理想的产前诊断方法。随着孕早期产前筛查的广泛开展,绒毛活检术的应用也越来越多(图1-5)。
目前,手术多在实时超声的介导下完成。超声用于观察胎儿是否合并结构性畸形,生长经线是否符合孕周,定位穿刺点,引导穿刺针方向,以及观察术中、术后胎心率变化。
(一)绒毛活检术
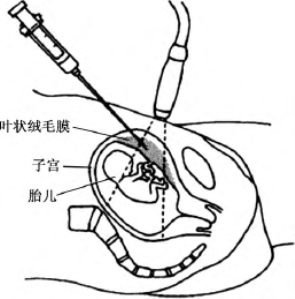
图1-5 孕早期绒毛活检术
1.手术时机 一般在妊娠10~14周进行,现多经孕妇腹部操作。对于孕中期羊水过少者也可进行绒毛穿刺。
2.绒毛活检量 不同诊断目的所需的组织量不同,染色体分析约需绒毛10mg,DNA分析5mg绒毛即可,而生化测定也仅需3~5mg组织。故一次绒毛活检获取20mg左右的绒毛组织可满足任何产前诊断的需要。
3.操作方法
(1)术前常规超声检查,测量胎儿顶臀径、羊水量及确定胎盘位置,了解胎儿是否有可见的结构性畸形。对于后壁或侧壁胎盘,可嘱孕妇适当充盈膀胱后再观察胎盘位置。
(2)孕妇取仰卧位,腹部常规消毒、铺巾,超声探头罩上无菌薄膜套,腹壁寻找并固定于最佳穿刺点。超声指示下,在穿刺点部位应用1%利多卡因做局部皮肤及皮下浸润麻醉,持18G绒毛穿刺专用引导套针在超声直视下刺入皮肤、皮下、筋膜、子宫壁,进入胎盘,退出针芯,将活检针经引导套针送入胎盘组织,活检针事先连接含有4~5ml生理盐水的20ml注射器。在超声直视下,以10~15ml的负压快速上下移动活检针5~6次吸取绒毛组织,拔针后观察注射器生理盐水中的绒毛量。如一次活检的绒毛量不够,可再次将活检针送入引导套针内进行抽吸,直到获取需要量的绒毛标本。腹部拔针后应记录胎儿心率。
4.手术并发症
(1)流产:是最严重的并发症,发生率与孕中期羊水穿刺相当,<1%。
(2)腹壁血肿:少数患者因损伤血管可出现血肿,罕见。
(3)感染:见于手术无菌操作不严格或未严格掌握适应证,罕见。
(4)刺破胎膜:抽吸未控制力度,穿刺针误入羊膜腔内,可抽出羊水或血水。在超声直视下并由有经验医师操作时,此并发症罕见。
(5)胎儿肢体发育障碍:多出现于妊娠10周前,可能与绒毛血管横断致肢体远端供血障碍有关。目前多主张在妊娠10周后进行绒毛穿刺,以尽量防止胎儿肢端发育障碍的可能。
(6)局限于胎盘的嵌合体:发生率为1%~2%。在部分妊娠,胎盘绒毛检查到的染色体异常并不出现于胎儿。出现这种情况增加了再次羊水穿刺的机会。
(二)羊膜腔穿刺术
本术式是应用最广、历史最久的产科操作技术,文献上最早记载的经腹羊膜腔穿刺术分别在1877年和1890年。1953年Bevis等报道通过羊水穿刺治疗母胎Rh血型不合。1961年,Liley等发表了著名的研究报告,即羊水中胆红素含量(波长450nm处光密度)与胎儿溶血病的严重程度呈一定比例。自此,羊水穿刺术成为一项产科临床上标准的操作技术。真正意义上的遗传学诊断出现于1956年,Fuchs等通过检查羊水细胞中的Barr小体判断胎儿性别。1966年,Steele等首次报道培养的羊水细胞用于染色体核型分析;1968年,Nadle等报道第一例羊水细胞培养诊断的21-三体病例。1970年,Nadler等在《新英格兰医学杂志》发表经典文献“羊水穿刺在宫内诊断遗传性疾病的作用(Role of amniocentesis in the intra-uterine diagnosis of genetic defects)”,极大地推动了遗传性羊水穿刺的应用。此后,这一技术开始流行,被广泛应用于染色体异常、X-连锁性疾病、先天性代谢性疾病以及神经管缺陷的产前诊断(图1-6)。(https://www.xing528.com)
1.取样时间 遗传学羊水穿刺多在15~20周,但羊水细胞培养的成功率甚至在孕晚期也能维持在90%以上。在绒毛穿刺技术普及前,曾出现过早期羊水穿刺(14周前),但胎儿流产机会和胎儿肢体发育障碍的发生率远高于前者,现早期羊水穿刺在临床已基本废弃。
2.抽取羊水量 视不同的诊断目的而定,一般传统的羊水细胞培养核型分析所需羊水20ml,而分子诊断只需羊水5~10ml。
3.操作方法
(1)术前常规超声检查,测量胎儿生长经线、羊水量及确定胎盘位置,了解胎儿是否合并有可见的结构性畸形。
(2)孕妇排空膀胱取仰卧位,常规消毒腹部、铺巾;超声探头罩上无菌薄膜套,寻找并固定于合适穿刺部位。前壁胎盘时应尽量避开胎盘,无法避开时应选择胎盘厚度最薄部位进针,同时应避开胎儿。持22GPTC针或20G腰穿针在超声指引下刺入宫腔,拔出针芯,接上20ml注射器,即可抽出羊水,应弃去最初的1~2ml。拔针后超声观察胎心及穿刺部位渗血,记录羊水性状、抽吸量、穿刺部位出血时间及胎心率。
4.手术并发症
(1)流产:羊膜腔穿刺术是侵入性诊断中最安全的产前诊断技术,与之相关的流产率约为0.5%。
(2)羊水渗漏:罕见。极个别病例可出现羊水自穿刺孔渗漏现象。如渗漏较严重可影响胎儿肺发育。

图1-6 羊膜腔穿刺术
(3)宫内感染:罕见。严格的无菌操作可避免感染的发生。
(4)损伤脐带、胎盘或胎儿:罕见。穿刺针偶可刺伤脐带或胎盘,导致脐带或胎盘血肿,亦可刺伤胎儿引起血肿。
(5)母体损伤:刺伤血管,导致腹壁血肿,子宫浆膜下血肿或刺伤胎盘可导致胎儿血进入母体。对Rh阴性孕妇,应注射抗D 免疫球蛋白,预防发生致敏反应。
(三)脐带血管穿刺术
脐带穿刺技术出现较晚。1983年,法国医生Daffos等首次报道脐带血管穿刺技术,在超声引导下,用20G穿刺针于妊娠18周左右经胎盘入口处的脐静脉内抽出纯胎血,他们报道了第1例用胎血诊断的甲型血友病。1985年,Hobbins等也报道了脐带血穿刺术,并称之为“经皮肤脐带血取样”。不久,英国医生Nicolaides首次实施脐血管穿刺的单人操作,即操作者一手持超声探头,另一只手持穿刺针。随着彩色血流显像超声仪的出现,该操作在技术上更易实现。目前,脐血管穿刺技术主要用于大孕周胎儿的快速核型分析(图1-7)。
1.穿刺时间 脐带血管穿刺多在妊娠18周后,孕周过小因脐带血管太细穿刺失败机会大。目前临床实际应用孕周一般在20周后,主要目的是快速核型分析。
2.取血量 一般取血量为1~2ml,取血量过多会影响胎儿血液循环,胎儿心动过缓等并发症发生率增高。
3.穿刺方法 术前常规超声检查,测量胎儿生长经线、羊水量、胎盘位置、脐静脉直径及胎心率等,了解胎儿一般情况,并观察脐带位置及走向,进行初步定位。脐带在声像图表现为漂浮于羊水中的管状结构,其中有一大二小的暗带,大者为脐静脉,小者为脐动脉,并可于胎盘胎儿面寻及脐带入口,彩色多普勒有助于辨别脐血管。前壁胎盘时穿刺点多选在脐带根部,此处脐带较固定,血管扭曲少,利于进针。当脐带根部难以显露或遭胎体遮挡时,选用暴露较好的脐带游离段。经腹脐静脉穿刺术有穿刺架引导和徒手操作两种方法。
(1)探头穿刺架引导:根据脐带暴露需要,孕妇取平卧位或半侧卧位,腹部常规消毒、铺巾。用配置了穿刺架的无菌超声探头定位脐带,调整探头位置,将脐带清晰地显示在引导区内。将探头固定,术者选好适当穿刺角度,将22GPTC针插入穿刺架的针槽内进针,刺入皮肤后便可见针尖回声呈一强光点,进针同时观察针尖轨迹是否与穿刺引导线一致,偏离时应调整。当针尖触及脐带时做迅速、有力而有节的冲击,针尖便能刺入圆滑的脐血管,拔出针芯,接5ml注射器抽吸,多能抽出胎血,拔针。压迫穿刺点片刻,继续超声观察胎盘脐带穿刺处有无渗血,监测胎心率、心音有无变化。
(2)徒手操作:由操作者一手把持超声探头,定位脐带后固定探头,另一只手持22GPTC针距离探头前方1cm皮肤处进针,双手配合引导穿刺针伸及脐带处,刺入脐血管后,术者固定穿刺针,由助手拔出针芯,接注射器抽吸胎血。

图1-7 脐带血穿刺术
4.胎血的鉴定 所获取的胎血样本需要常规进行胎血鉴定,以确定标本中是否混有母血污染,从而确保检测结果的准确性。若证实被母血污染,应考虑重复穿刺取样。
(1)血红蛋白分析:因胎儿血红蛋白组分与成年人显著不同,若胎血中出现Hb A2及较多量的Hb A,则判断为母血污染。应用高效液相色谱法(HPLC)检测胎血样本,5min即可完成。
(2)Kleihaure抗酸染色法:将胎血制成薄而均匀的涂片,自然干燥后置于80%乙醇固定5min,再浸入柠檬酸-磷酸盐酸缓冲(pH3.3~5.0,37℃)液洗脱5min。自然干燥后用0.5%伊红溶液染色3min。经上述步骤后,胎儿血红蛋白未被洗脱,仍为双凹圆盘状,色鲜红。而成年人血红蛋白被洗脱,呈无色空泡状。
(3)抗碱变性试验:取试管1支,加入1/12mol/L NaOH(或KOH)溶液2ml,滴加少许胎血,摇匀,1min后肉眼观察,胎血(HbF抗碱变性的能力比HbA强)不变色,暗红,成年人血则变色(HbA变性),为棕色。
5.手术并发症
(1)穿刺失败:孕周过小,脐带血管太细;羊水过多,脐带漂浮,活动度增加;胎动频繁,脐带难以固定;孕妇精神紧张,子宫收缩,穿刺针移动困难;这些都可造成穿刺失败。因此,术前要确定孕周及胎儿宫内情况,并安抚孕妇情绪。如果连续3次进针均未抽到胎血,则为穿刺失败,应停止继续穿刺,观察胎心率变化。
(2)胎儿一过性心动过缓:多出现于穿刺引起一时性子宫收缩或针刺脐带引起脐血管痉挛,导致胎儿一过性心动过缓。此时应立即停止穿刺,孕妇左侧卧位,吸氧,多数在1min内恢复正常。必要时给予孕妇0.5mg的阿托品溶入50%葡萄糖注射液静脉推注。
(3)胎儿丢失:高于羊膜腔穿刺和绒毛穿刺,与术者经验相关。文献报道,即使由技术熟练的操作者操作,发生率也为1.4%。因此临床必须把握好产前诊断指征,术前向病人告知产前诊断风险,术时做好预防抢救措施。
(4)羊膜感染:穿刺必须严格遵守无菌操作,避免引起宫腔感染。
(5)胎盘、脐带渗血:穿刺针经过胎盘或脐带可引起渗血,一般出血在1~2min自止。此时需超声持续监测出血情况和胎心变化。
五、禁 忌 证
产前诊断一般认为是较为安全的手术,引起胎儿流产的概率为0.5%~1%,但出现以下情况时应暂缓穿刺。
1.术前感染未治愈,或手术当天感染及可疑感染者。
2.中央性前置胎盘或前置、低置胎盘有出血现象。
3.先兆流产未治愈者。
4.孕妇无明确的手术指征。
六、产前诊断样本的实验室检查
若所取样本为胎盘绒毛,实验室检查前应仔细挑选,尽量去除母体组织,解剖显微镜有助于辨认绒毛结构。所取样本为羊水,应记录羊水性状;若混较多母血,不宜直接用于分子诊断,可先置于瓶中培养,换液后应用贴壁的羊水细胞进行基因分析。
1.核型分析 传统的产前诊断方法是培养绒毛或羊水细胞,进行染色体显带核型分析,包括了检查细胞内全部23对染色体。除临床常见的非整倍体(如21-三体、18-三体、13-三体及性染色体异常外),这种方法还能检测出结构性染色体畸变,如平衡或不平衡易位,倒位等。一般绒毛和或羊水细胞的核型分析费时2~3周,但胎血培养时间短,只需3~5d。
2.快速核型分析 为分子遗传学技术,临床常用的有荧光原位杂交(FISH)和荧光定量PCR技术,前者需要特异性的DNA标记探针,后者需要荧光素标记的引物特异性扩增染色体内的短串联重复序列。这些方法可以同时诊断5种常见染色体(21-三体,18-三体,13-三体,X,Y)的数目异常,1~2d完成,敏感性和特异性近乎100%。但对染色体结构异常或针对的5种染色体之外的其他染色体异常,快速核型分析方法不能诊断。目前临床应用上,常将快速核型分析作为传统核型分析的辅助方法,用以快速产前诊断和早期减轻侵入性穿刺术后孕妇的精神压力。
3.微阵列比较基因组杂交技术(aCGH) 该技术是选择DNA特殊片段作为靶,固化在载体上,形成密集、有序的分子微阵列。然后,从测试标本中提取DNA,将测试DNA和参考DNA用不同的荧光色素标记,杂交到微阵列上,通过检测这两种荧光色素的比率,了解待测标本基因拷贝数的变化。与传统的细胞核性分析技术相比,aCGH具有很大的优越性:能够检测染色体亚微结构异常(微重复、微缺失),解析度高;不需培养细胞,只需少量DNA样本,产前诊断快速;做单一的一次杂交即可检查肿瘤整个基因组的染色体拷贝数量的变化;技术操作可以实现自动化。但aCGH也存在局限性,例如试剂及设备价格昂贵,尚不能普及;不能检测平衡易位,也不能检测多倍体。
4.基因诊断 通过分子生物学和分子遗传学的技术,直接检测出分子结构水平和表达水平是否异常,从而对疾病作出判断。基因诊断可分为两类:一类是直接检查致病基因本身的异常。它通常使用基因本身或紧邻的DNA序列作为探针,或通过PCR扩增产物,以探查基因无突变、缺失等异常及其性质,这称为直接基因诊断,它适用已知基因异常的疾病;另一类是基因间接诊断。当致病基因虽然已知但其异常尚属未知时,或致病基因本身尚属未知时,也可以通过对受检者及其家系进行连锁分析,以推断前者是否获得了带有致病基因的染色体。连锁分析是基于紧密连锁的基因或遗传标记通常一起传给子代,因而考察相邻DNA是否传递给了子代,可以间接地判断致病基因是否传递给子代。需要的样本量少,精确度高,但要鉴别胎儿样本中是否混有母体组织污染。
七、产前诊断的意义
多数遗传病由亲代传递,少数可能是由于某些条件父母的配子细胞基因发生致病性变异,成为新的传播遗传病的源头。若遗传病基因代代相传,给人类社会的危害是长期的。由于大部分遗传病尚无有效的治疗手段,阻止遗传病危害的有效途径就是阻止患儿的出生。产前诊断的目的就是对胎儿在出生前是否患有某种遗传病或先天畸形作出诊断,一旦诊断胎儿是遗传病患者,应立刻进行选择性流产,以杜绝遗传病患儿的出生。目前产前诊断已成为世界各国应用最广泛、实用价值最为显著的遗传病防治措施。
(廖 灿)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




