118.如何进行羊布鲁菌病的实验室诊断?
羊布氏杆菌的实验室诊断可用细菌学检查、血清学实验及变态反应等方法。
(1)细菌学检查 包括直接镜检和分离培养。其方法步骤为:①采集病料。最好采集流产胎儿的胃内容物、肺、肝、脾和流产胎盘及羊水;②病料涂、抹片,作革兰染色和柯兹罗夫斯基(鉴别染色法)染色,镜检,若发现革兰阴性、鉴别染色呈红色的球杆菌或短小杆菌,即可做出初步诊断;③将病料接种于含5%~10%马血清的胰化酪蛋白大豆胨琼脂等培养基2板(若为污染病料,在100毫升培养基中加入结晶紫6000国际单位,或多黏菌素E2500国际单位),分别置大气环境或5%~10%CO2环境,37℃培养。每3天观察1次,如有细菌生长,可挑选可疑菌落(菌落大小不等,直径一般为0.5~1.0毫米,无色透明、表面光滑湿润、有光泽、透光呈淡黄色及侧光呈现微乳色和略带蓝灰色)做涂片、染色、镜检,做鉴定;若无细菌生长,则继续培养30天。
(2)血清学试验 方法有多种,凝集反应因其特异性和敏感性均较高,且操作较简便,目前得以广泛应用。羊感染布鲁菌7~15天左右,血液中即出现凝集素,随后凝集素滴度逐渐增高,可持续很长时间。在大规模羊群检疫时,常先用平板凝集试验或乳汁环状试验进行初筛试验,以试管凝集试验和补体结合试验进行最后确诊。
①平板凝集试验
a.试剂与材料
ⅰ.抗原。本方法所用抗原由指定单位提供,按说明书使用。本抗原为淡蓝色的悬浮液,有凝集者须废弃。使用前充分振荡,并使其温度达到20℃左右。
ⅱ.受检血清。受检血清必须新鲜,无明显蛋白凝固,无溶血现象和无腐败气味。加入防腐剂的血清自采血之日算起,最迟于15日内检验。试验前须置于温室中,使其温度达到20℃左右。
ⅲ.阳性血清。由指定单位提供。通常取自人工免疫的家畜,但也可从送检血清中选取。凝集价最好不低于1∶800。
ⅳ.阴性血清。由指定单位提供。
ⅴ.器具。移液器、玻璃板、酒精灯、牙签或火柴棒。
b.操作方法
ⅰ.取洁净玻璃板一块,用玻璃记号笔化成4平方毫米小格,每列5格。
ⅱ.用移液器按表5-2所示先后加血清、抗原、生理盐水、阳性血清、阴性血清(单位:微升)。
ⅲ.用牙签或自血清量少的格开始依次向前搅拌混合。每格血清用一根牙签。用过的牙签要放在固定容器内,工作完毕后,集中烧毁。
ⅳ.混合完毕后,放于酒精灯上稍加温,使之均匀达30℃左右,于5~8分钟内判定结果。
ⅴ.按下列标准用加号记录反应强度
++++:出现大的凝集片或小的颗粒,液体完全透明,即为100%凝集。
表5-2 试验次序
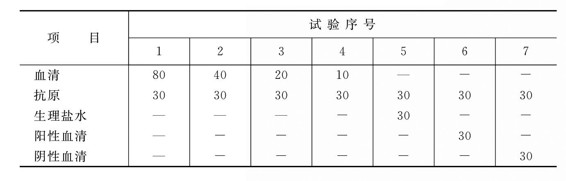
+++:有明显的凝块,液体几乎完全透明,即为75%凝集。
++:有可见的凝块,液体不甚透明。即为50%菌体凝集。
+:仅仅可以看出颗粒物,液体浑浊,即为25%凝集。
-:液体均匀浑浊,无凝集现象。
c.试验结果的判定
ⅰ.绵羊、山羊血清40微升,凝集呈“++”以上时,判定为阳性;80微升凝集呈“++”以上时,判为可疑。
ⅱ.可疑反应的羊,经3~4周,须重新采血,检验。如果重检时仍为可疑,则判定为阳性。
ⅲ.将试验结果通知畜主时,须注明凝集价。
②乳汁环状试验(全乳环状反应)
a.试剂与材料
ⅰ.抗原。目前我国生产两种全乳环状反应抗原。一种是苏木素染色抗原,呈蓝色;另一种是四氮唑染色抗原,呈红色。试验时不论哪种抗原,均按乳脂的颜色和乳柱的颜色进行判定。
ⅱ.受检乳。受检乳须为新鲜的全脂乳。凡腐败、变酸和冻结的不能用(采集的乳,夏季应于当天内检查,如保存于2℃时,7天内仍可使用);患乳房炎及其他乳房疾病母牛以及初乳不适于本法之用;脱脂乳及煮沸过的乳亦不能做环状反应用。
ⅲ.器具。移液器、灭菌小试管、水浴锅。
b.操作办法
ⅰ.采集4个乳头的新鲜全乳相混合后,吸取1毫升盛于灭菌小试管中。
ⅱ.按抗原标签的规定向小试管中加入全乳环状反应抗原1滴(约0.05毫升),充分振荡混合。
ⅲ.置37~38℃水浴中60分钟。
ⅳ.而后,小心取出试管(勿使振荡),立即进行判定。(https://www.xing528.com)
c.判定标准
强阳性反应(+++):乳柱上层的乳脂形成明显红色或蓝色的环带。乳柱呈白色,分界清楚。
阳性反应(++):乳脂层的环带虽呈红色或蓝色,但不如“+++”显著,乳柱微带红色或蓝色。
弱阳性反应(+):乳脂层环带颜色较浅,但比乳柱颜色略深。
疑似反应(±):乳脂层环带不甚明显,并于乳柱之分界模糊,乳柱带有红色或蓝色。
阴性反应(-):乳柱上层无任何变化,乳柱呈均匀浑浊的红色或蓝色。
注意:脂肪较少或无脂肪的牛乳呈阳性反应时,菌体呈凝集现象下沉管底,判定时以乳柱的反应为标准。
③试管凝集试验
a.试剂与材料
ⅰ.抗原。由指定单位提供。本抗原是将布氏杆菌死菌体悬浮于0.5%苯酚(石炭酸)生理盐水中制成。静置时上层为清亮无色或略呈灰白色的液体,瓶底有菌体沉淀,使用时须充分摇匀。我国的抗原是用国际标准标定制造的,抗原的1∶20稀释液对国际标准阳性血清凝集价恰为1∶1000“++”。使用时用0.5%苯酚(石炭酸)生理盐水作1∶20稀释。有霉菌污染或出现凝集块的抗原不能应用。
ⅱ.受检血清。受检血清必须新鲜,无明显蛋白凝固,无溶血现象和无腐败气味。加入防腐剂的血清自采血之日算起,最迟于15天内检验。
ⅲ.阳性血清。由指定单位提供,通常取自人工免疫的家畜,但也可从送检血清中选取,凝集价最好不低于1∶800。
ⅳ.阴性血清。由指定单位提供。
ⅴ.试验用稀释液。0.5%苯酚(石炭酸)10%盐水溶液,用化学纯苯酚(石炭酸)5毫克和化学纯食盐100毫克加至1000毫升蒸馏水中制成,经高压灭菌后备用。
b.操作方法
ⅰ.受检血清的稀释和抗原的加入。一般情况下,山羊、绵羊用1∶25和1∶50两个稀释度。
每份血清用5支小试管(口径8~10毫米),第1、第3、第4、第5管各加入2.3毫升0.5%苯酚(石炭酸)的10%盐水溶液(检验羊血清专用稀释液),第2管不加。用1毫升吸管吸取受检血清0.2毫升,加入第一管中,并混合均匀。混合方法:是将该试管中的混合液吸入吸管内,再沿管壁吹入原试管中,如此吸入、吹出3~4次。混匀后,以该吸管吸取混合液分别加入第2管和第3管,每管0.5毫升。以该吸管将第3管的混合液混匀(方法同前)吸取0.5毫升加入第4管混合后,又从第4管吸出0.5毫升加入第5管,第5管混匀后弃去0.5毫升。如此稀释之后从第2管起血清稀释度分别为1∶12.5,1∶25,1∶50和1∶100。
加入抗原的方法是:先以0.5%苯酚(石炭酸)10%盐水溶液将抗原原液做20倍稀释,然后加入上述各管(第1管不加,留作血清蛋白凝集对照),每管0.5毫升,振摇均匀,加入抗原后,第2~5管各管混合液的容积均为1毫升,血清稀释度从第2管起依次变为1∶25,1∶50,1∶100和1∶200。
Ⅱ.对照管的制作。做了每次试验须做3种对照各1份。
ⅰ.阴性血清对照。阴性血清的稀释和加抗原的方法与受检血清同。
ⅱ.阳性血清对照。阳性血清对照须稀释到其原有滴度,加抗原的方法与受检血清相同。
ⅲ.抗原对照(了解抗原是否有自凝现象)。加1∶20抗原稀释液0.5毫升于试管中,再加0.5毫升0.5%苯酚(石炭酸)10%盐水溶液稀释。
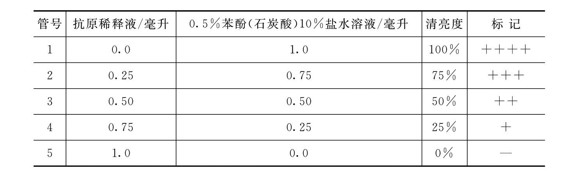
Ⅲ.比浊管的制作。每次试验须配制比浊管作为判定清亮程度(凝集反应程度)的依据,配制方法如下:取本次试验用的抗原稀释液(即抗原原液20倍稀释液)5~10毫升,加入等量的0.5%苯酚(石炭酸)10%盐水溶液,做倍比稀释(稀释倍数为2、4、8、16、32等),然后按表5-3配制比浊管。
表5-3 比浊管配制
Ⅳ.全部试管充分振荡后置于37~38℃恒温箱中22~24小时,然后,取出检查并记录结果。
Ⅴ.记录结果。根据各管中上层液体的清亮度记录凝集反应的强度(凝集价),特别是50%清亮度(即“++”的凝集)对判定结果关系很大。需用比浊管对照判定。
++++:完全凝集和沉淀,上层液体100%清亮(即100%菌体下沉)。
+++:几乎完全凝集和沉淀,上层液体75%清亮。
++:显著凝集和沉淀,液体50%清亮。
+:沉淀明显,液体25%清亮。
-:无沉淀,不清亮。
确定每份血清的效价时,应以出现两个“++”以上的凝集现象(即50%的清亮)的最高血清稀释度为血清的凝集价。
c.试验结果的判定
ⅰ.山羊、绵羊于1∶50稀释度出现“++”以上的凝集现象时,被检血清判定为阳性反应;于1∶25稀释度出现“++”以上凝集现象时,被检血清判定为可疑。
ⅱ.可疑反应的羊,经3~4周,须重新采血检验,如果重检时仍为可疑,该羊判定为阳性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




