为了加强保健食品的监督管理,保证保健食品质量和人体食用安全。《中华人民共和国食品安全法》第51条规定,国家对声称具有特定保健功能的食品实行严格监管。有关监督管理部门应当依法履职,承担责任。具体管理办法由国务院规定。国家食品药品监督管理局(SFDA)于2005年4月30日审议通过了《保健食品注册管理办法(试行)》,自2005年7月1日起施行。
3.2.6.1 保健食品的概念及其注册
(1)保健食品概念保健食品是指声称具有特定保健功能或者以补充维生素、矿物质为目的的食品。即适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生任何急性、亚急性或者慢性危害的食品。
(2)保健食品注册保健食品注册是指国家食品药品监督管理局根据申请人的申请,依照法定程序、条件和要求,对申请注册的保健食品的安全性、有效性、质量可控性以及标签说明书内容等进行系统评价和审查,并决定是否准予其注册的审批过程;包括对产品注册申请、变更申请和技术转让产品注册申请的审批。
国家食品药品监督管理局主管全国保健食品注册管理工作,负责对保健食品的审批。省、自治区、直辖市食品药品监督管理部门负责对国产保健食品注册申请资料的受理和形式审查,对申请注册的保健食品的试验和样品试制进行现场核查和样品检验。国家食品药品监督管理局确定的检验机构负责申请注册的保健食品的安全性毒理学试验、功能学试验、功效成分或标志性成分检测、卫生学试验、稳定性试验等。
申请人在申请保健食品注册之前,应当做相应的研究工作。研究工作完成后,申请人应当将样品及其与试验有关的资料提供给国家食品药品监督管理局确定的检验机构进行相关的试验和检测。拟申请的保健功能应在国家食品药品监督管理局公布的27种功能范围内,拟申请的保健功能不在公布范围内的,申请人还应当自行进行动物试验和人体试食试验,并向确定的检验机构提供功能研发报告,功能研发报告应当包括功能名称、申请理由、功能学检验及评价方法和检验结果等内容。无法进行动物试验或者人体试食试验的,应当在功能研发报告中说明理由并提供相关的资料。
(3)保健食品注册功能保健食品可以分成两个大类,一类是具有特定保健功能的食品;一类是以补充维生素、矿物质为目的的食品(通称“营养素补充剂”)。
一般申请注册的保健食品的功能应在公布的27种功能范围内,具体申请注册的保健食品的27个功能如表3.3所示。
表3.3 保健食品注册功能
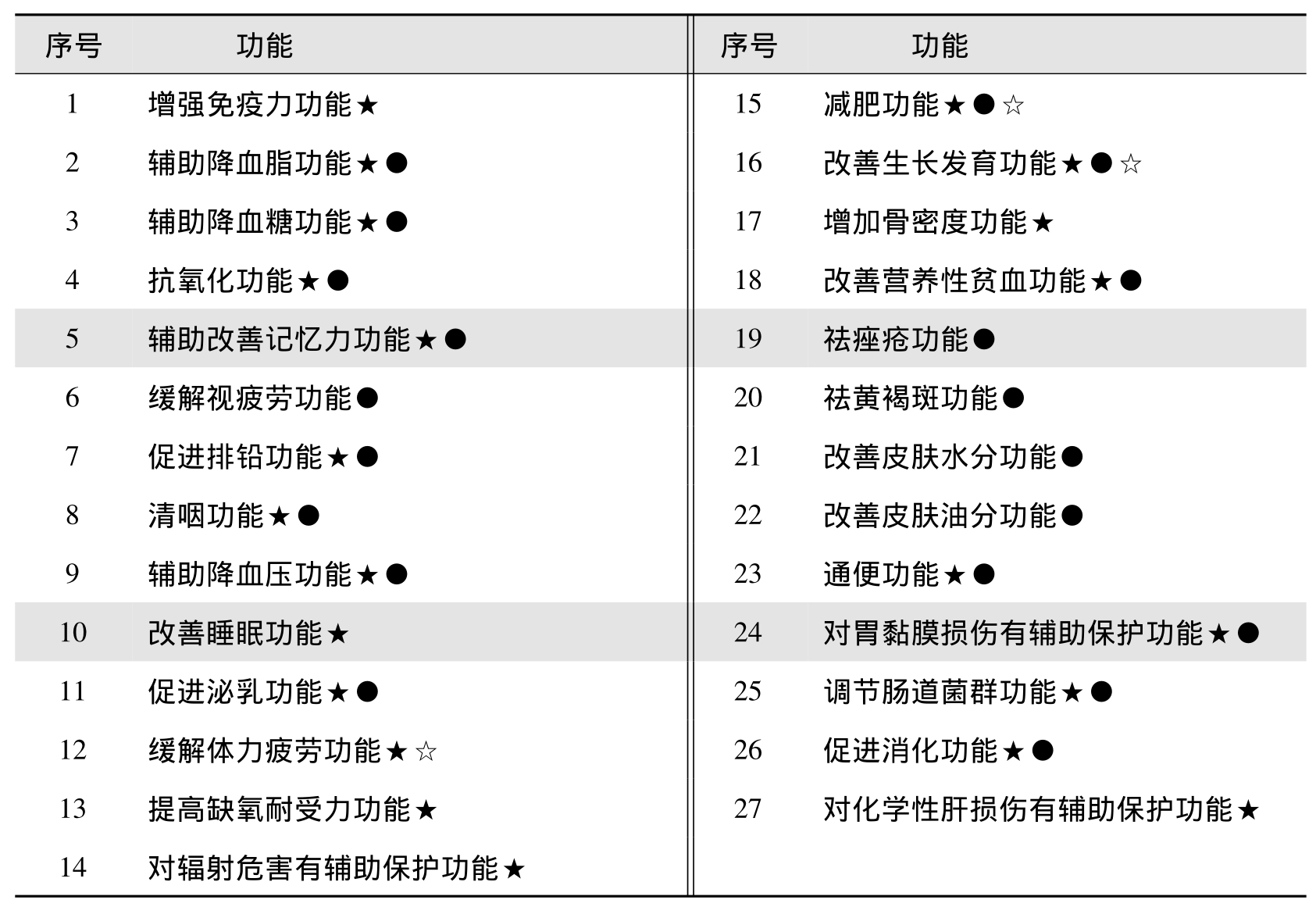
注:标有★的功能,需进行动物功能试验。
标有●的功能,需进行人体功能试验。
标有☆的功能,需做兴奋剂检测。
3.2.6.2 保健食品注册申请与审批
保健食品注册申请包括国产保健食品注册申请和进口保健食品注册申请。国产保健食品注册申请,是指申请人拟在中国境内生产销售保健食品的注册申请。进口保健食品注册申请,是指已在中国境外生产销售1年以上的保健食品拟在中国境内上市销售的注册申请。国家食品药品监督管理局根据报送的资料和样品,对符合要求的,在80 d内组织食品、营养、医学、药学和其他技术人员对申报资料进行评审和审查,并作出审查决定。准予注册的,向申请人颁发《国产保健食品批准证书》和《进口保健食品批准证书》。
保健食品批准证书有效期为5年。
国产保健食品批准文号格式为:国食健字G+4位年代号+4位顺序号;
进口保健食品批准文号格式为:国食健字J+4位年代号+4位顺序号。
(1)国产保健食品产品注册申请申报资料项目和审批程序国产保健食品产品注册申请申报资料项目。
1)保健食品注册申请表。
2)申请人身份证、营业执照或者其他机构合法登记证明文件的复印件。
3)提供申请注册的保健食品的通用名称与已经批准注册的药品名称不重名的检索材料(从国家食品药品监督管理局政府网站数据库中检索)。
4)申请人对他人已取得的专利不构成侵权的保证书。
5)提供商标注册证明文件(未注册商标的不需提供)。
6)产品研发报告(包括研发思路、功能筛选过程、预期效果等)。
7)产品配方(原料和辅料)及配方依据;原料和辅料的来源及使用的依据。
8)功效成分/标志性成分含量,及功效成分/标志性成分的检验方法。
9)生产工艺简图及其详细说明和相关的研究资料。(https://www.xing528.com)
10)产品质量标准及其编制说明(包括原料、辅料的质量标准)。
11)直接接触产品的包装材料的种类、名称、质量标准及选择依据。
12)检验机构出具的试验报告及其相关资料,包括:试验申请表;检验单位的检验受理通知书;安全性毒理学试验报告;功能学试验报告;兴奋剂、违禁药物等检测报告(申报缓解体力疲劳、减肥、改善生长发育功能的注册申请);功效成分检测报告;稳定性试验报告;卫生学试验报告;其他检验报告(如原料鉴定报告、菌种毒力试验报告等)。
13)产品标签、说明书样稿。
14)其他有助于产品评审的资料。
15)两个未启封的最小销售包装的样品2件。
(2)进口保健食品产品注册申请申报资料项目审批程序申请进口保健食品注册,除根据使用原料和申报功能的情况按照国产保健食品申报资料的要求提供资料外,还必须提供以下资料。
1)生产国(地区)有关机构出具的该产品生产企业符合当地相应生产质量管理规范的证明文件。
2)由境外厂商常驻中国代表机构办理注册事务的,应当提供《外国企业常驻中国代表机构登记证》复印件。
境外生产厂商委托境内的代理机构负责办理注册事项的,需提供经过公证的委托书原件以及受委托的代理机构营业执照复印件。
3)产品在生产国(地区)生产销售1年以上的证明文件,该证明文件应当经生产国(地区)的公证机关公证和驻所在国中国使领馆确认。
4)生产国(地区)或国际组织的与产品相关的标准。
5)产品在生产国(地区)上市使用的包装、标签、说明书实样。
6)连续三个批号的样品。
3.2.6.3 原料与辅料的管理
保健食品的原料是指与保健食品功能相关的初始物料。保健食品的辅料是指生产保健食品时所用的赋形剂及其他附加物料。保健食品所使用的原料和辅料应当符合国家标准和卫生要求。无国家标准的,应当提供行业标准或者自行制定的质量标准。国家食品药品监督管理局和国家有关部门规定的不可用于保健食品的原料和辅料,禁止使用的物品不得作为保健食品的原料和辅料。
国家公布的可作为保健食品的原料包括:
(1)普通食品的原料普通食品的原料,食用安全,可以作为保健食品的原料。
(2)既是食品又是药品的物品共87个。主要是中国传统上有食用习惯、民间广泛食用,又在中医临床中使用的物品。
(3)可用于保健食品的物品共114个。这些品种经SFDA批准可以在保健食品中使用,但不能在普通食品中使用。
(4)列入《食品安全国家标准食品添加剂使用卫生标准》和《营养强化剂卫生标准》的食品添加剂和营养强化剂。
(5)可用于保健食品的真菌和益生菌菌种可用于保健食品的真菌(11种)名单:酿酒酵母;产朊假丝酵母;乳酸克鲁维酵母;卡氏酵母;蝙蝠蛾拟青霉;蝙蝠蛾被毛孢;灵芝;紫芝;松杉灵芝;红曲霉;紫红曲霉。可用于保健食品的益生菌(11种)名单:两歧双歧杆菌;婴儿两歧双歧杆菌;长两歧双歧杆菌;短两歧双歧杆菌;青春两歧双歧杆菌;保加利亚乳杆菌;嗜酸乳杆菌;嗜热链球菌;干酪乳杆菌干酪亚种;罗伊氏乳杆菌。
(6)一些列入药典的辅料如赋形剂、填充剂。
(7)不在上述范围内的品种也可作为保健食品的原料,但是须按照有关规定提供该原料相应的安全性毒理学评价试验报告及相关的食用安全资料。
保健食品禁用物品共有59个,主要包括:①国家保护一、二级野生动植物及其产品;人工驯养繁殖或人工栽培的国家保护一级野生动植物及其产品;②肌酸、熊胆粉、金属硫蛋白等。
3.2.6.4 保健食品标签与说明书管理
保健食品的标签与说明书内容必须经国家食品药品监督管理局审查,不得有虚假和夸大宣传。产品的标签及说明书,必须标注国家食品药品监督管理局的批准文号和保健食品特有标志,内容应当包括产品名称,主要原(辅)料,功效成分/标志性成分及含量,保健功能,适宜人群,不适宜人群,食用量与食用方法,规格,保质期,储藏方法和注意事项等。
3.2.6.5 保健食品的监督管理
卫生行政部门和食品药品监督管理部门负责保健食品的监督检验工作。发现未经食品药品监督管理部门审批,以保健食品名义宣传和生产销售的,将根据《食品安全法》、《保健食品注册管理办法(试行)》有关规定进行查处。同时对已批准的保健食品可以进行重新审查,对审查不合格产品,食品药品监督管理局撤销《保健食品批准证书》。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




