14.2.5 生产实例
1.毛花洋地黄叶中强心苷的生产工艺
毛花洋地黄为玄参科植物毛花洋地黄(Digitalis lanata)的干燥叶,在临床应用已有百年历史。近代临床及药理研究表明,毛花洋地黄中的强心苷类成分是治疗心力衰竭的有效成分。由毛花洋地黄叶中分离出30余种强心苷,多为次生苷,属于原生苷的有毛花洋地黄苷A、B、C、D、E(lanatoside A、B、C、D、E),以苷A和苷C的含量较高,苷C亲水性强,临床适于制成注射剂。从毛花洋地黄中分离的次生苷——去乙酰毛花洋地黄苷C(商品名:西地兰cedilanid-D)和异羟基洋地黄毒苷(商品名:地高辛digoxin)不适于口服,可制成注射剂,为治疗心力衰竭的速效强心剂。
(1)去乙酰毛花洋地黄苷C和异羟基洋地黄毒苷的结构式
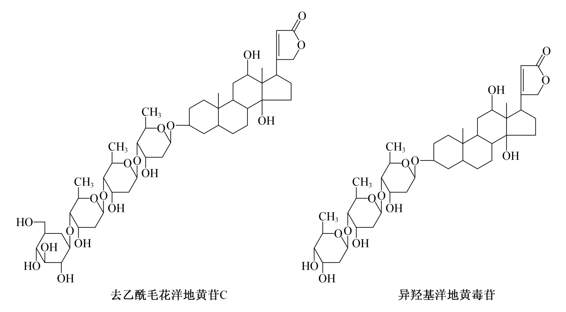
(2)理化性质
1)性状:去乙酰毛花洋地黄苷C为无色晶体,分子式C47 H74 O19,相对分子质量942,熔点256~268℃(分解),[α]20D=+12.2°(75%乙醇)。异羟基洋地黄毒苷为白色结晶,分子式C41 H64 O14,相对分子质量780.95,熔点260~265℃(有不明显的分解)。
2)溶解性:去乙酰毛花洋地黄苷C能溶于水(1∶500)、甲醇(1∶200)或乙醇(1∶2500),微溶于三氯甲烷,几不溶于乙醚。异羟基洋地黄毒苷易溶于吡啶,微溶于稀醇,极微溶于三氯甲烷,不溶于水或乙醚。
(3)毛花洋地黄叶中去乙酰毛花洋地黄苷C的生产工艺
【工艺原理】
利用毛花洋地黄总苷的溶解性,采用甲醇或70%~80%的乙醇作为溶剂进行提取,再根据毛花洋地黄苷A、B、C的极性和溶解度差别,分离毛花洋地黄苷C。采用氢氧化钙去除毛花洋地黄苷C结构中的乙酰基,即得去乙酰毛花洋地黄苷C。
【操作过程及工艺条件】
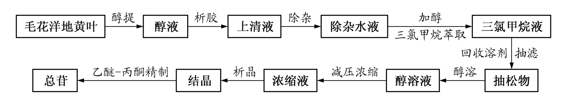
工艺总路线:

1)总苷的提取:①醇提:取毛花洋地黄叶粗粉,加5倍量70%热乙醇,于60℃浸渍2小时后渗漉,收集渗漉液,接近终点时再加2倍量70%冷乙醇进行二次渗漉,合并渗漉液;②析胶:渗漉液用碳酸钠调pH至中性,在60℃以下减压回收乙醇至含醇量为10%~20%,15℃以下放置过夜,静置析胶;③浓缩-除杂:次日吸取上清液,减压回收乙醇,用0.4倍量三氯甲烷萃取除去树脂、色素、脂溶性杂质等;④进一步除杂:水液加乙醇至含醇量为22%,再用0.3倍三氯甲烷萃取2次,除去糖及水溶性杂质;⑤抽滤-醇溶:回收有机溶剂,抽滤,加适量甲醇,加热至完全溶解;⑥浓缩-析晶:回收甲醇至剩余量为抽松物的0.3~0.4倍,再加入抽松物重量的0.04倍蒸馏水及少量晶种,摇匀,静置,析晶,滤取结晶;⑦重结晶:于析出结晶的浓缩液中加入适量的乙醚-丙酮(2∶1)混合溶剂,搅拌成浆状,静置过夜,抽滤,合并两次所得结晶,以适量乙醚-丙酮(1∶1)混合溶剂洗涤,挥去溶剂,烘干,得总苷(主要含毛花洋地黄苷A、B、C)。
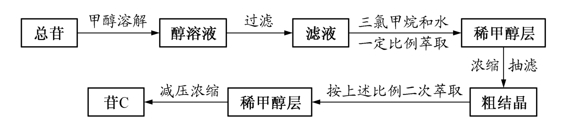
2)苷C的分离:①第一次分离:采用总苷-甲醇-三氯甲烷-水(1∶100∶500∶500)的混合溶剂系统进行分离。先将总苷溶于甲醇,过滤,再向甲醇液中加三氯甲烷和水振摇萃取,分取甲醇层,减压浓缩至小体积,抽滤,得粗结晶;②第二次分离:按粗结晶-甲醇-三氯甲烷-水(1∶100∶500∶500)的混合溶剂系统进行二次分离,可将苷C从总苷中分离出来。
3)苷C去乙酰基:①去乙酰基:按苷C-甲醇-氢氧化钙-水[1g∶33m l∶(50~70)mg∶33m l]先将苷C溶于甲醇中,氢氧化钙溶于水中,分别过滤,混合均匀,静置过夜,混合液调pH7,过滤,滤液减压浓缩至约1/5的体积,放置过夜,抽滤,得结晶;②重结晶:将结晶溶于热甲醇中,趁热抽滤,滤液放置析晶,抽滤,得去乙酰毛花洋地黄苷C(西地兰)纯品。
【生产工艺流程】
1)总苷的提取:
2)苷C的分离:
3)苷C去乙酰基:

【工艺注释】
1)总苷的提取:①总苷的提取采用高浓度乙醇温浸,目的是使毛花苷酶失去活性,将亲水性较强的原生苷提取出来。温浸后采用渗漉法提取两次,可保证提取完全。②毛花洋地黄叶中含有大量的叶绿素、树脂等脂溶性杂质,采用碳酸钠调pH至中性,在60℃以下减压回收乙醇至含醇量为10%~20%,于15℃以下静置可析出大量的胶体,必要时可进行二次析胶以保证析胶完全。③在20%乙醇溶液中加入三氯甲烷,可进一步纯化总苷。
2)苷C的分离:①总苷中苷A及苷C的含量较高,约为47%及37%,而苷B的含量较低,故分离苷C的关键是将苷C与苷A分离完全。根据苷C在三氯甲烷中的溶解度比苷A小,在甲醇和水中的溶解度与苷A相近的性质,采用总苷-甲醇-三氯甲烷-水(1∶100∶500∶500)的比例进行分离,苷A在极性小(含醇的三氯甲烷)的溶剂中含量较多,苷C在极性大(含甲醇的水)的溶剂中含量较多。②在实验中,应严格按给出的溶剂配比进行萃取。
3)苷C去乙酰基:①按苷C-甲醇-氢氧化钙-水[1g∶33m l∶(50~70)mg∶33m l]进行配比,可有效去除乙酰基、保护C17位内酯环不被破坏;②混合液应呈中性,若出现偏酸性或偏碱性,则应以Ca(OH)2或HCl调节pH值。
(4)毛花洋地黄叶中异羟基洋地黄毒苷的生产工艺
【工艺原理】
利用毛花洋地黄叶中自身存在的酶进行发酵酶解,除去一分子糖,再根据次生苷的溶解性,用乙醇进行提取,加入碱液去除乙酰基和除杂,活性炭脱色,采用三氯甲烷、丙酮或乙醇进行分离纯化,即得。
【操作过程及工艺条件】
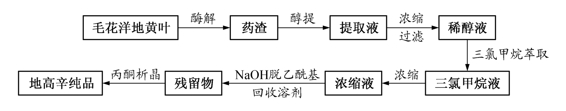
1)酶解:取毛花洋地黄叶粗粉,加等量水,拌匀,在40~50℃酶解20小时,过滤,得酶解后药渣。
2)醇提-浓缩:取酶解后药渣加80%乙醇回流提取,提取液减压浓缩至含醇量为20%,静置,析胶。
3)过滤-萃取:过滤浓缩液,除去胶状物,浓缩液用三氯甲烷萃取3次,合并三氯甲烷溶液。
4)碱洗-去乙酰基及除杂:三氯甲烷溶液用10% NaOH水溶液反复萃取,达到脱乙酰基及除杂质的目的。
5)浓缩-析晶:回收有机溶剂,加入少量丙酮,放置,析晶。
6)重结晶:取结晶,加入80%乙醇使溶解,趁热过滤,滤液放置,析晶,得异羟基洋地黄毒苷(地高辛)纯品。
【生产工艺流程】
【工艺注释】
1)酶解条件:加等量水,温度40℃,酶解20小时,在酶解过程中要不断地搅拌。
2)醇沉浓度为20%,可使析胶完全,胶状物为叶绿素、树脂等杂质。
3)用10% NaOH溶液萃取洗涤,可达到碱水解去除2-去氧糖上乙酰基的目的,同时去除酸性杂质及脂溶性杂质。
2.黄花夹竹桃果仁中的强心苷
黄花夹竹桃为夹竹桃科植物黄花夹竹桃(Thevetia peruviana)的果仁。近代临床及药理研究表明,黄花夹竹桃次苷A和B具有强心作用,能增加心脏收缩幅度,对心功能衰竭具有一定作用,可代替洋地黄类强心药治疗心力衰竭;次苷A能增加冠脉、股动脉及全身血管的外周阻力,增加血管收缩。此外,黄花夹竹桃苷能通过抑制肿瘤细胞的Na+,K+_ATP酶活性,提高胞内cATP含量而抑制肿瘤细胞的增殖并使其向正常细胞转化。
黄花夹竹桃的主要有效成分是强心苷,果仁中含量最丰富,脱脂果仁中达8%~10%,树皮、叶含量较少。已分离出的原生苷有黄花夹竹桃苷A(thevetin A)和黄花夹竹桃苷B(thevetin B),还有水解产生的次生苷:黄花夹竹桃次苷A(peruvoside)、次苷B(neriifolin)、次苷C(ruvoside)、次苷D(perusitin)及单乙酰黄花夹竹桃次苷B(cerberin)。国内临床应用的黄花夹竹桃苷(商品名:强心灵neriperside)为从黄花夹竹桃中得到的次生苷的混合物,主要是黄花夹竹桃次苷A、黄花夹竹桃次苷B和单乙酰基黄花夹竹桃次苷B及1~3种极少量的其他强心苷,其强心效价比原生苷高5倍左右。
(1)黄花夹竹桃苷的结构式
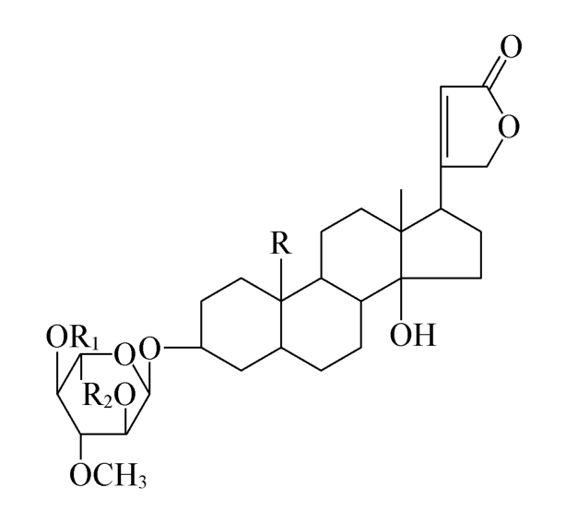
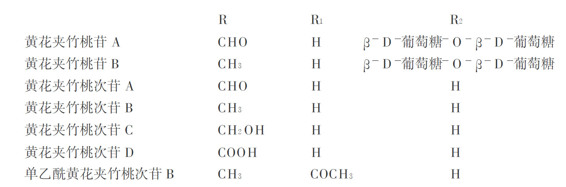
(2)理化性质
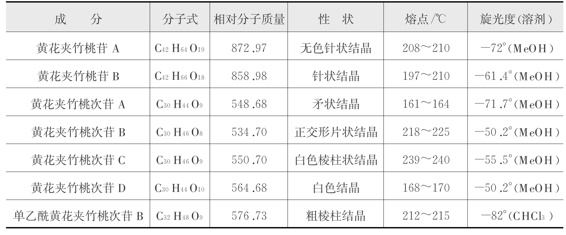
1)性状:具体见表14-12。
(https://www.xing528.com)
表14-12 黄花夹竹桃苷类的性状等
2)溶解性:黄花夹竹桃苷A和黄花夹竹桃苷B为极性较大的苷,可溶于甲醇、乙醇,易溶于水,微溶于乙酸乙酯、含醇三氯甲烷溶液,几乎不溶于乙醚、苯、石油醚等。而黄花夹竹桃次苷A、B、C、D及单乙酰黄花夹竹桃次苷B属于亲脂性苷,可溶于甲醇、乙醇,易溶于含醇三氯甲烷溶液、三氯甲烷、乙醚等,难溶或几乎不溶于水。如黄花夹竹桃次苷A在水中溶解度为1g∶2500m l,易溶于三氯甲烷和丙酮,微溶于甲醇和乙醇。
(3)黄花夹竹桃果仁中黄花夹竹桃苷A、B的生产工艺
【工艺原理】
黄花夹竹桃多以果仁入药,富含脂溶性杂质,在提取强心苷时先用石油醚或汽油脱脂,再根据溶解性采用醇提法,黄花夹竹桃混合苷的分离常采用逆流分溶法。
【操作过程及工艺条件】
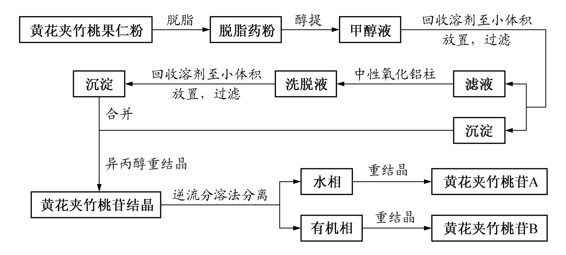
1)脱脂-醇提:取黄花夹竹桃果仁粉以石油醚脱脂后,取脱脂后的粉末500mg用甲醇浸泡提取4次,合并浸提液。
2)浓缩-过滤:在60℃以下减压回收甲醇至250m l,放置,析出沉淀,过滤,得沉淀和滤液两部分。
3)柱分离:滤液上中性氧化铝柱,用水洗脱,收集洗脱液。
4)浓缩-放置:洗脱液于60℃以下减压浓缩至小体积,放置,又析出沉淀。
5)重结晶:合并沉淀,以85%异丙醇重结晶,得黄花夹竹桃苷结晶,熔点196~198℃,纸色谱鉴定为黄花夹竹桃苷A及B。
6)逆流分溶法分离:将此结晶用逆流分溶法分离,即取9个分液漏斗(编号0~8),每个漏斗中各加150m l水[用三氯甲烷-乙醇(2∶1)预饱和],在“0”号漏斗中加入1g结晶和750m l三氯甲烷-乙醇(2∶1,用水预饱和),振摇5分钟,放置分层。“0”号漏斗中的有机溶剂层放入“1”号漏斗中,而在“0”漏斗中加入新的750m l三氯甲烷-乙醇(2∶1,用水预饱和)。同上振摇,分层,如此进行逆流分布,最后得9个有机溶剂相和9个水相。
7)重结晶:将2~5号的水相合并蒸干,加水溶解,趁热过滤,滤液静置析晶,得黄花夹竹桃苷A。将6~7号有机溶剂相合并回收有机溶剂,用甲醇与乙醚的混合溶剂进行重结晶,得黄花夹竹桃苷B。
【生产工艺流程】
【工艺注释】
1)采用醇类溶剂提取,由于其穿透力强、提取率高,同时还能使伴随的酶失活。
2)黄花夹竹桃苷A、B的分离常采用逆流分溶(CCD)法,即利用强心苷在两相溶剂中分配系数的差异,在两相溶剂中作逆流移动,不断重新分配并达到分离的目的,是一种多次、连续的液-液萃取分离过程,特别适合中等极性且结构不稳定物质的分离。
3)以三氯甲烷-乙醇(2∶1)混合液750m l与水150m l为两相溶剂,其中,三氯甲烷为移动相,水为固定相。
(4)黄花夹竹桃果仁中单糖苷的生产工艺
【工艺原理】
提取黄花夹竹桃中的亲脂性单糖苷、次生苷及苷元时,常利用酶的活性,在适宜的条件下,使原生苷水解为次生苷。利用其溶解性及极性大小,采用醇类溶剂提取法与色谱分离相结合的方法进行提取和分离。
【操作过程及工艺条件】
1)发酵:取脱脂的黄花夹竹桃果仁粉末,加5倍量水及少量甲苯,强烈振摇后于37℃放置发酵4天。
2)醇提:取发酵后药渣,加入等体积乙醇,振摇,室温放置过夜,过滤。药渣用乙醇冷浸1次,再用热乙醇提取1次,合并醇提取液。
3)浓缩-析晶:取醇提取液在60℃减压回收乙醇至1/5体积,放冷析晶,得总强心苷。
4)色谱分离:将此结晶用Ⅲ级中性氧化铝柱色谱分离,用苯-三氯甲烷(1∶1、1∶3、1∶4)、三氯甲烷、三氯甲烷-甲醇(99.5∶0.5、99∶1、98∶2、95∶5、9∶1、1∶1)、甲醇依次洗脱,合并相同组分。
5)重结晶:将合并后的相同组分分别用甲醇重结晶,依次得单乙酰黄花夹竹桃次苷B、黄花夹竹桃次苷B、黄花夹竹桃次苷A、黄花夹竹桃次苷C、黄花夹竹桃次苷D。
【生产工艺流程】
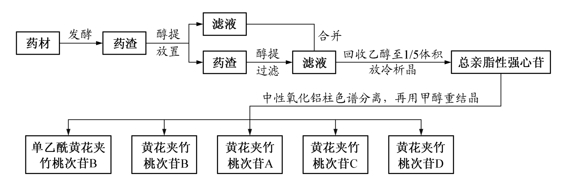
【工艺注释】
1)发酵时,除了加入5倍量水,还应加入少量甲苯,有助于提高酶解的效率。
2)减压回收溶剂时应控制温度在60℃以下,温度过高可使有效成分受到破坏。
3)发酵后的次生苷,极性下降,多采用中性氧化铝为吸附剂进行柱色谱分离。
(5)黄花夹竹桃果仁中强心灵的生产工艺
【工艺原理】
强心灵主要为单乙酰黄花夹竹桃次苷B、黄花夹竹桃次苷B和黄花夹竹桃次苷A的混合物,是果仁中的原生苷经酶解后产生的次生苷,利用其溶解性,可采用醇提水沉法提取;利用次生苷极性下降,微溶于水的性质进行分离纯化。
【操作过程及工艺条件】
1)脱脂-酶解:取黄花夹竹桃果仁粉末,经石油醚脱脂后,加入4倍量的水及2.5%甲苯,加塞于35~40℃的恒温箱中酶解24小时。
2)醇提:取发酵后的粉末,加乙醇15倍量,浸泡12小时,渗漉,再加乙醇10倍量继续渗漉,合并渗漉液。
3)浓缩-水沉:将渗漉液减压回收乙醇至体积为1∶2.5(生药∶浓缩液),加相当于脱脂粉末12.5倍量水,放置,使沉淀完全,过滤,得粗品。
4)醇溶-脱色:粗品用40倍量乙醇加热溶解,加适量活性炭,煮沸,趁热过滤。
5)浓缩-水沉:滤液减压浓缩至粗品5倍量的体积,加入3倍量水,放置,过滤。
6)洗涤-干燥:结晶以乙醚洗涤,70℃干燥,得强心灵。
【生产工艺流程】

【工艺注释】
1)强心灵的化学结构属于次生苷,其强心效价比原生苷提高5倍左右,故进行部分的苷键裂解,酶解比酸水解温和,能够保证苷元结构不被破坏。
2)在醇提液的水沉操作中,加入相当于脱脂粉末12.5倍量水,恰好使极性大的杂质溶解于水中,而有效成分次生强心苷基本不损失,达到去除水溶性杂质的目的。
3)加活性炭脱色,主要是去除脂溶性杂质。
4)经此工艺得到的强心苷含量可达95%以上。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




