1.氢氧化钠标准溶液的配制与标定
由于氢氧化钠易吸水,不能直接配成准确浓度的溶液,因而必须先配成近似浓度的溶液,再用标准的酸溶液或酸性盐的基准物质来标定。选用的基准物质通常是邻苯二甲酸氢钾或草酸,指示剂选用酚酞。如配制0.1mol/L氢氧化钠溶液,先称取分析纯的固体氢氧化钠4.1g,用蒸馏水溶解后转移到1000mL容量瓶,定容至刻度。溶液保存在带橡皮塞的试剂瓶中,待标定。
用邻苯二甲酸氢钾(KHC8H4O4,相对分子质量204.214)作为基准物质。准确称取三份邻苯二甲酸氢钾0.41~0.43g,分别置于150mL三角瓶中,各加入20mL蒸馏水,使全部溶解,加3~4滴酚酞指示剂,用待标定的氢氧化钠溶液滴定至淡红色出现为止,记下氢氧化钠的滴定体积,通过计算即可求出氢氧化钠的标准浓度。
c=m×1000/M×V
式中 c——氢氧化钠标准溶液浓度,mol/L;
m——KHC8H4O4的质量,g;
M——KHC8H4O4的摩尔质量,204.214g/mol;
V——NaOH的滴定体积,mL。
2.盐酸标准溶液的配制与标定
标定盐酸通常选用硼砂或无水碳酸钠为基准物质,指示剂选用甲基红。如配制0.1mol/L盐酸标准液,吸取分析纯盐酸8.5mL,用蒸馏水稀释至1000mL,保存在试剂瓶中,待标定。
用硼砂(Na2B4O7·10H2O,相对分子质量381.42)作为基准物质,准确称取三份干燥的硼砂0.38~0.39g分别放在150mL三角瓶中,加入20mL蒸馏水,使溶解,加入3滴甲基红指示剂,用待标定的盐酸滴定至橙红色为止,记下盐酸的滴定体积,通过计算即可求出盐酸溶液的标准浓度。
c=m×1000/(M/2)×V
式中 c——盐酸标准溶液浓度,mol/L;
m——Na2B4O7·10H2O的重量,g;
M——Na2B4O7·10H2O的摩尔质量,381.42g/mol;
V——HCl的滴定体积,mL。
若采用无水碳酸钠(Na2CO3,相对分子质量105.98)作为基准物质,使用前必须在270~300℃下烘干约1h,然后置于干燥器中冷却备用。称取Na2CO3重量为0.13~0.14g,滴定至终点时,应煮沸溶液1~2min,以消除CO2的影响,冷却至室温,继续滴定至变为橙红色。
c=w×1000/(M/2)×V
式中 c——盐酸标准溶液浓度,mol/L;
w——Na2CO3的重量,g;
M——Na2CO3的摩尔质量,105.98g/mol;
V——HCl的滴定体积,mL。
3.硫代硫酸钠标准溶液的配制与标定
标定硫代硫酸钠溶液通常选用重铬酸钾为基准物质,淀粉为指示剂。如配制0.1mol/L硫代硫酸钠溶液,称取分析纯硫代硫酸钠25g,溶解在煮沸后冷却的蒸馏水中,定容至1000mL,于棕色试剂瓶中保持,一周后再进行标定。
用重铬酸钾(K2Cr2O7,相对分子质量294.19)作为基准物质。准确称取三份经130℃烘干的重铬酸钾0.12~0.13g分别放在250mL碘量瓶中,加入20mL蒸馏水使之溶解,加入10mL 3mol/L H2SO4和15mL 10% KI充分混合(滴定前才加入KI,否则KI和H2SO4溶液放置过久,过量的KI易被空气部分氧化成I2),暗处放5min( 和I-的反应不是立刻完成的,在稀溶液中进行的更慢,所以应待反应完全以后再加水稀释,在上述条件下大约需经5min才能完成),之后加50mL蒸馏水稀释,用Na2S2O3滴定,滴定到溶液呈浅黄色,加1%淀粉指示剂2mL(淀粉指示剂不宜加的过早,否则大量的I2与淀粉结合生成蓝色络合物,络合物中的I2不易和Na2S2O3溶液迅速作用),继续加入Na2S2O3,直到蓝色刚刚消失而呈Cr3+的绿色为止,记下Na2S2O3溶液用量后,再多加一滴Na2S2O3溶液,如果颜色不再改变,表示滴定已经完成。
和I-的反应不是立刻完成的,在稀溶液中进行的更慢,所以应待反应完全以后再加水稀释,在上述条件下大约需经5min才能完成),之后加50mL蒸馏水稀释,用Na2S2O3滴定,滴定到溶液呈浅黄色,加1%淀粉指示剂2mL(淀粉指示剂不宜加的过早,否则大量的I2与淀粉结合生成蓝色络合物,络合物中的I2不易和Na2S2O3溶液迅速作用),继续加入Na2S2O3,直到蓝色刚刚消失而呈Cr3+的绿色为止,记下Na2S2O3溶液用量后,再多加一滴Na2S2O3溶液,如果颜色不再改变,表示滴定已经完成。
c=m×1000/(M/6)×V
式中 c——硫代硫酸钠标准溶液浓度,mol/L;
m——K2Cr2O7的重量,g;
M——K2Cr2O7的摩尔质量,294.19g/mol;
V——Na2S2O3的滴定体积,mL。
注意事项:(https://www.xing528.com)
硫代硫酸钠溶液不稳定,容易分解,因为:
(1)细菌的作用: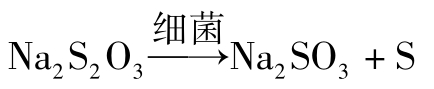
(2)溶解在水中的CO2的作用:
(3)空气的氧化作用: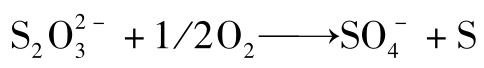
此外,水中微量的Cu2+或Fe3+也能促使Na2S2O3溶液分解。因此配制Na2S2O3溶液时,需要用新煮沸并冷却了的蒸馏水,除去CO2和杀死细菌,并加入少量Na2CO3(每1000mL溶液加0.2g使溶液呈弱碱性,以抑制细菌的生长)。这样配制的溶液比较稳定,但也不宜长期保存,使用一段时间后要重新进行标定。如果发现溶液变混或析出硫,就应该过滤后再标定,或者另配溶液。
4.高锰酸钾标准溶液的配制与标定
KMnO4试剂常含有少量MnO2和其他杂质,另外,蒸馏水中常含有少量的有机物质,能使KMnO4还原,且还原产物能促进KMnO4自身分解,见光使分解更快。因此,KMnO4溶液的浓度容易改变,不能用直接法,必须正确地配制和保存,如果长期使用必须定期进行标定。
标定KMnO4的基准物质较多,其中Na2C2O4不含结晶水,容易提纯,没有吸湿性,是常用的基准物。如配制0.1mol/L高锰酸钾标准溶液,称取16~18g固体KMnO4,置于大烧杯中,加水至1000mL,加热煮沸10~15min,置于棕色玻璃塞试剂瓶中,于暗处放置一周后,用微孔玻璃漏斗或玻璃棉漏斗过滤,滤液装入棕色细口瓶中,待标定。
用草酸钠(Na2C2O4,相对分子质量134.02)作为基准物质,滴定时利用 本身的紫红色指示终点,称为自身指示剂。准确称取0.7~0.8g基准物质Na2C2O4三份,分别置于250mL的锥形瓶中,加蒸馏水20mL使之溶解,再加2mol·L-1H2SO415mL,盖上表面皿,在石棉铁丝网上慢慢加热到70~80℃(刚开始冒蒸汽的温度),趁热用高锰酸钾溶液滴定。开始滴定时反应速度慢,待溶液中产生了Mn2+后,滴定速度可适当加快,直到溶液呈现微红色并持续半分钟不褪色即终点(终点时温度不低于60℃)。根据Na2C2O4的质量和消耗KMnO4溶液的体积计算KMnO4浓度。
本身的紫红色指示终点,称为自身指示剂。准确称取0.7~0.8g基准物质Na2C2O4三份,分别置于250mL的锥形瓶中,加蒸馏水20mL使之溶解,再加2mol·L-1H2SO415mL,盖上表面皿,在石棉铁丝网上慢慢加热到70~80℃(刚开始冒蒸汽的温度),趁热用高锰酸钾溶液滴定。开始滴定时反应速度慢,待溶液中产生了Mn2+后,滴定速度可适当加快,直到溶液呈现微红色并持续半分钟不褪色即终点(终点时温度不低于60℃)。根据Na2C2O4的质量和消耗KMnO4溶液的体积计算KMnO4浓度。
c=2×m×1000/(5M×V)
式中 c——高锰酸钾标准溶液浓度,mol/L;
m——Na2C2O4的质量,g;
M——Na2C2O4的摩尔质量,134.02g/mol;
V——滴定消耗的高锰酸钾的体积,mL。
注意事项:
(1)蒸馏水中常含有少量的还原性物质,使KMnO4还原为MnO2·nH2O。高锰酸钾试剂内含的细粉状的MnO2·nH2O能加速KMnO4的分解,故通常将KMnO4溶液煮沸一段时间,冷却后,还需放置2~3d,使之充分作用,然后将沉淀物过滤除去。
(2)在室温条件下,KMnO4与 之间的反应速度缓慢,所以加热提高反应速度。但温度又不能太高,如温度超过85℃则有部分H2C2O4分解。
之间的反应速度缓慢,所以加热提高反应速度。但温度又不能太高,如温度超过85℃则有部分H2C2O4分解。
(3)滴定过程如果发生棕色浑浊(MnO2),应立即补加H2SO4溶液,使棕色浑浊消失。
(4)开始滴定时,反应很慢,在第一滴KMnO4还没有完全褪色以前,不可加入第二滴。当反应生成能使反应加速进行的Mn2+后,可以适当加快滴定速度,但过快则导致局部KMnO4过浓而分解,放出O2或引起杂质的氧化,都可造成误差。
(5)KMnO4标准溶液应放在酸式滴定管中,由于KMnO4溶液颜色很深,液面凹下弧线不易看出,因此,应该从液面最高边上读数。
5.EDTA标准溶液的配制与标定
标定EDTA溶液的基准物质通常采用碳酸钙或氧化镁。如配制0.1mol/L EDTA(C10H14N2O8Na2·H2O,相对分子质量372.24)溶液,称取分析纯乙二胺四乙酸二钠37.4g,加蒸馏水溶解,稀释定容至1000mL,于试剂瓶中保存,待标定。
用碳酸钙(CaCO3,相对分子质量100.1)作为基准物质,准确称取经120℃烘干的CaCO31.2~1.3g,于烧杯中用少量蒸馏水润湿,然后小心滴加6mol/L HCl使其溶解,最后转移到100mL容量瓶中,用蒸馏水定容至刻度。量取三份25mL CaCO3溶液分别置于150mL三角瓶中,加10% NaOH调pH至12,再加钙红指示剂少许,立即用EDTA溶液滴定,溶液由酒红色变为纯蓝色为滴定终点。记下EDTA的滴定体积,通过计算即可求出EDTA的标准体积。
c=(m×25/100)×1000/M×V
式中 c——EDTA标准溶液浓度,mol/L;
m——CaCO3的重量,g;
M——CaCO3的摩尔质量,100.1g/mol;
V——EDTA的滴定体积,mL。
注:钙红指示剂是紫黑色粉末,它的水溶液或乙醇溶液都不稳定,所以一般取固体试剂用氯化钠粉末稀释后使用,即1g钙红指示剂与99g氯化钠混匀研细。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




