(一)误差的种类
测定值与真实值之差叫误差,测定值是用分析手段通过一系列操作,包括计算机处理在内而获得的数据。它分为直接测定值和间接测定值,直接测定值是用分析仪器直接求得不需要函数计算,如用天平称出的质量;间接测量值是根据几个参变数,用一定的函数公式运算而得,如水的悬浮物。任何分析结果都包含误差,误差可分为系统误差、随机误差、过失误差。
1.系统误差
系统误差是由于某种确定原因引起的比较恒定的误差,使多次测定的平均值X对真实值u偏高或偏低,即误差或正或负,当测定条件不变,对同一样品重复测定时,这种误差会重复地表现出来,其数值的大小和符号可通过试验确定,属于可测误差,因而是可以校正或可设法去除。系统误差可用式(6-57)表示:
![]()
系统误差由分析过程中的固定原因引起,如方法的缺陷、仪器标定不正确、试剂不纯和分析人员的恒定个人误差等。因此,只要分析条件不变,它就会在每次分析中再现,符号和大小都不变。
2.随机误差
随机误差又称偶然误差,是由一些来源不十分清楚的在分析过程中随机出现的偶然因素引起的单次测定值Xi对多次测定平均值X的偏差。对同一样品的每次重复测定时,其符号和大小都在变化。偶然误差可用式(6-58)表示:
![]()
例如称量时,分析天平的感量是0.1mg,几次称量同一物体,重量读数常有±0.1mg的差别。还有,滴定管读数常会相差±0.01m L等,这些都是难以避免的。其他一些无法控制的因素如样品质量的不均匀、温度、压力的变化、电子仪器的噪音和基准的漂移、分析人员判断能力的差异和读数的前后不一致等都是产生偶然误差的原因。偶然误差是难于控制的,不可测定的,也无法校正。但是,当对一个量进行重复很多次测量时,正、负偏差出现的次数大致相同,小偏差出现的次数多,大偏差出现的次数少,然后把测量结果进行统计,就会发现偶然误差具有正态分布规律。
3.过失误差
过失误差是由于不遵循操作规程所造成的误差,它是由于分析人员疏忽大意,误操作、读错、记错等造成的。过失误差是可以避免的。
(二)精密度和准确度
精密度是指在规定的条件下,用同一方法对一均匀试样进行重复分析时,所得分析结果之间的一致性程度,由分析的偶然误差决定,分析的偶然误差越小则分析的精密度越高。
准确度是指用一个特定的分析程序所得单次测定值或多次测定值的平均值与真实值之间的符合程度。测定值或平均值越接近真实值,则误差越小,越准确。准确度取决于总测量误差,它是系统误差和偶然误差的综合指标。对于经过多次重复测定得到的算术平均值,其偶然误差已接近消除,这时准确度主要与系统误差有关,它决定着一个分析结果的可靠性。
精密度很高的测定,准确度不一定高,这是由于系统误差存在的关系。精密度不高的测定,准确度就不可能很高,这是由于随机误差存在的关系。理想的情况是精密度和准确度都很高,只有在既消除了系统误差,又尽可能通过精细操作而得到精密度较高的数次分析结果时才能做到。用算术平均值比用单一测定值表示分析结果,其准确度更加可靠。
系统误差、随机误差、精密度、精确度之间区别与关系可以用图(6-11)说明。

图6-11 随机误差、精密度、精确度的区别与关系
图中,(a)的系统误差小,随机误差大,精密度、精确度都不好;(b)的系统误差大,随机误差小,精密度很好,但精确度不好;(c)的系统误差和随机误差都很小,精密度和精确度都很好。
(三)误差表示方法
1.系统误差的表示法——绝对误差和相对误差
多次测定的平均值X与真实值u之差称为绝对误差,用符号E表示;绝对误差在真实值中所占的百分率叫相对误差,用符号RE表示,即

绝对误差有正负,其单位与测定值的单位相同;相对误差也有正负,其单位可用百分率或千分率表示。
2.偶然误差的表示方法——绝对偏差和偶然偏差
从产生偶然误差的规律来看,多次测定的平均值接近真实值。此时,用来表示偶然误差的方法就是测定值与平均值之差,称为绝对偏差。以示与绝对误差相区别,符号为D。绝对偏差在平均值中所占的百分率叫相对偏差,符号为RD,即

在实际工作中常把平均值视为真实值,因而把偏差当作误差混用,但在概念上应严格区别。通常将绝对误差 (或偏差)简称误差 (或偏差),省略 “绝对”两字,相对误差(或相对偏差)则必须使用全称。
偏差或相对偏差只能反映单次测定结果的偶然误差,不能反映一群数据的精密度,而精密度是评价一个分析方法优劣的重要指标。对一组数据的偶然误差常用极限偏差和标准偏差来表示。标准偏差的计算公式如下:

式中 S——标准偏差,其含义为每个测定值Xi对平均值 的平均偏离程度。
的平均偏离程度。

标准偏差是表示数据群偏离中心值(即平均值)的程度,标准偏差大,精密度差;标准偏差小,精密度好。它的最大优点是对特大偏差和特小偏差较为敏感。
(四)分析误差的判断
在分析化验的实际工作中,常常由于实验条件控制不当或分析方法不完整,使系统误差和偶然误差交织在一起,对分析结果造成影响。因此,在进行误差分析时,判断误差的性质并加以区别是很重要的。
系统误差是可知误差,凭借专业知识和经验就可进行判断,但在复杂的情况下需要借助于数理统计知识。常用的判断方法有如下几种:
1.回收试验
所谓回收试验是在试样中加入一定量的与被测组分相同的标准物质或纯物质,用同一方法进行分析,以分析结果中被测组分的增大值相对于加入量的百分率来表示系统误差的大小,称为加标回收率,其计算式如下:
![]()
式中 Xs——加入纯物质(或标准物)的样本测定值,g;
Xi——样本测定值,g;
Ms——加入的纯物质(或标准物)的量,g。
经过多种试样和每种试样的多次回收率测定后,在一定的概率下求出回收率的置信范围。如果在该范围内不包括100%,就表明可能存在系统误差。显然,回收率以接近100%时,系统误差最小。在这里,纯物质或标准物的加入量视为假定的真实值,纯物质或标准物的回收,代表样本中被测物的回收。
当然,如果加入的纯物质或标准物本身就存在着系统误差,或者加入的标准物在形态上或性质上与被测物不一致时,则求得的系统误差并不能客观反映分析中的系统误差。尽管如此,这个方法目前仍被广泛采用,特别是用来估计分析中是否存在有干扰物质,尤为适用。经回收试验,若回收率太低,说明分析中存在有干扰物质。
2.对照试验
所谓对照实验就是对已知准确含量的标准物质,在相同的分析条件下进行的试验。这里,假定标准物的保证值是公认的真实值。如果对标注物进行多次测定的平均值和公认的真实值之间,在一定概率下存在着显著性差异或平均值落在真实值的置信范围以外,就表明可能存在系统误差。
标准物质可根据不同的目的,选用标准溶液,基准物或与待测物组分相似的标准试样。也可用公认的标准方法进行对照试验,该方法的系统误差应小至可以忽略不计。
3.协同试验
所谓协同试验是由许多个实验室参加,使用同一方法对同一试样进行多次测定,根据各实验室所提供的测定值(或平均值)进行方差分析,确定该方法的系统误差。
(五)减少分析误差的方法(https://www.xing528.com)
从上述讨论可知,分析误差来源于系统误差和偶然误差。为了减少偶然误差,对试样可仔细进行多次分析取其平均值作为分析的最终结果。但增加次数势必会增加工作量和耗费工时和材料消耗。
根据偶然误差的统计规律,平均值的标准差S x与测定次数n的平方根成反比,与各测定值的标准差S成正比,如式(6-66)所示:

表6-9 测定次数与误差减少的关系

提高分析准确度的方法,主要是减少或消除分析中的系统误差,为此,需先检验分析结构中的总误差有多大,然后对误差的性质进行判断,如存在系统误差,则应采用以下措施以消除或校正:
(1)选择准确度高的分析方法。在许多情况下系统误差的存在是由于分析方法本身的缺陷所致,而各种分析方法可能达到的准确度显然不会一样。因此,选择准确度高的分析方法是消除系统误差的根本措施。
(2)对照试验。对照试验的含义已如上述,对照试验不仅可以发现系统误差,而且还可以求出校正系数以消除分析结果中的系统误差。
校正系数时用标准试样(或纯物质)与未知试样在完全相同的条件下,用同一方法进行测定求出,将测定结果按下列关系计算:

式中 Xs——标准试样中组成的准确含量,%;
X′s——标准试样的测定结果,%;
Xi——待测试样中组成的含量,%;
X′i——待测试样的测定结果,%;
K——校正系数。
对照试验是把标准物中组成的准确含量视为真实值,当标准物本身存在有系统误差或者标准物在组成上与试样有较大的差距时,求得的校正系数并不一定完全消除系统误差。因此,在用已知校正系数对新的未经分析的试样进行校正时,要特别慎重。
(3)空白试验。由于试剂不纯和杂质带进的系统误差,可作空白试验来消除。空白试验就是在不加试样的情况下,按照分析试样同样的操作手续进行分析,所得结果称为空白值,从试样的测定结果中扣除空白值,就可消除因试剂不纯等原因造成的系统误差。
(4)仪器校正。当测定结果的允许相对误差大于1%时,一般仪器都不必校正。如允许相对误差较小,则根据情况需要对仪器及各种测量仪表进行校准。
最后,为了避免试验中出现的过失误差,必须严格要求自己对工作的责任心,严格遵守操作规程和养成良好的科学工作作风。
(六)有效数字及其运算规则
化学分析在数字的运算和报出结果时,确定用几个小数是很重要的。认为一个数值中小数点后面的位数愈多,这个数就愈准确,是一个错误的概念。其实小数点的位置仅与所用的单位有关,而不能决定准确度,例如321.2mg与0.3212g的准确度完全相同,但小数点后的位数却是不同。另外如果认为一个数在运算中保留小数点后的位数愈多,这个数愈准确,也是错误的。事实上决定准确度的因素是试验方法、仪器仪表的精度以及人的分辨能力等,而与计算结果的小数位数无关。所以,决不能把准确度增加到超过测量所能达到的精度,例如把测定热值的结果计算到3572.83Cal/g,显然是不合适的,因为已超出常用量热计对热值的测量精度。当然,如果记录的位数过少,低于试验所能达到的精确度,同样也是不对的。正确的写法是所写出数字的位数,其中除末位数字为可疑或不准确外,其余各位数字都是准确的。
1.有效数字
(1)有效数字的位数。有效数字是指有意义的数字,在化学分析中,就是实际能测量到的数字。

如果所用的分析天平能称准至±0.0001g;滴定管能读准到±0.01m L;温度计能读准到0.1℃;则上述坩埚重量是19.4734±0.0001g,滴定剂的体积应是21.41±0.01m L,温度计的读数为23.5±0.1℃,这些数值最后一位是不准确的,反复测量同一量时,这位数字常常波动不定,所以称为不定数字或可疑数字。其他数字都是可靠的,有效数字就是可靠数字和不可靠数字的总和。
数字中的“0”,可能是有效数字或可疑数字,也可能只是起定位作用而不是有效数字,这应根据具体情况而定,例如:

若给出一个数字为32000μg,则后面3个0很难判断是有效数字还是只起定位作用,对此情况,有两种处理办法:①改变计量单位,如变为32.0mg,则为三位有效数字;②改用科学记数,即用10的乘方表示很大或者很小的数。习惯上小数点前只保留一位整数,例如可以写成3.20×104μg,则指数前为有效数字,仍然是三位。
除了“0”不一定是有效数字外,其余数字1、2、3、4、5、6、7、8、9都是有效数字。
(2)有效数字的修约法则。任何数据的最后一位是不定数字;不定数字只保留一位。例如,若用1/10000g的天平称取1.0000g时,不能写成1g,因为这样,数字1本身也就成了不定数字。再如用感量1/10g的台称称量物体的重量,如果是10.4g,就不能写成10.40g,因为10.4中的4已经是一个不定数字,所以后面的0就没有意义了。因此,在记录实验数据和计算结果时应根据使用仪器的准确度和运算规则保留有效数字。有效数字的位数确定后,后面的数字按四舍六入五成双的法则修订,即舍弃的数字第一位大于5,则进1,小于5则舍去不计;等于5时,如前一位为奇数,则进1成为双数,如为偶数,则舍去不计。如5后面还有数字并非全为0时,则进1,例如:

舍去的数字,如非一个数字时,不得对该数字进行连续修约。应按上述规则对舍弃的第一个数字进行修约。例如13.4546,保留两位有效数字时,不应13.4546→13.455→13.46→13.5→14;而应13.4546→13。
2.有效数字的运算规则
有效数字的运算规则如下:
(1)有效数字的加、减、乘、除运算法则是根据极值误差传递规律制定的,即加减运算,和或差的绝对误差较任何一个数的绝对误差大;乘除运算,积或商的相对误差较任何一个数的相对误差大。
因此,所得结果有效数字的确定:加减法以小数位数最少的数,乘除法以有效数字最少或相对百分误差最大的数为准,其他数弃去多余的位数。
1)加减法示例。

正确的算法应在运算前,先确定应保留的小数位数,按修约法则弃去那些不必要的数字,然后再作计算。
2)乘除法示例。
![]()
三个数的相对百分误差为:
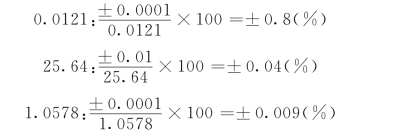
第一个数只有三位有效数字,其相对百分误差最大,应以此数为准,确定其他数的有效数字位数。按修约法则弃去多余的位数,都应保留三位有效数字,然后相乘得:
0.0121×25.6×1.06=0.328
(2)在作乘除、开方、乘方等运算时,若第一位有效数字为8或者大约8的数,其有效数字的位数可以多取一位:例如0.9可视为两位有效数字。
(3)在对数计算时,所取对数位数与真数有效数字的位数相等。
(4)在所有计算式中,如2的平方根、1/2等以及常数π、e等的有效数字位数可以无限制保留,需要几位就写几位。
(5)平均值的有效数字位数的保留原则。若测定值遵从正态分布,其平均值接近真实值,是可信赖的最佳值,其精度优于个别测定值。因此,在计算不少于4个测定值的平均值时,平均值有效数字的位数可增加一位。求平均值时,若各测定值的精度相同,用算术平均值;若精度不同,用加权平均值。
最后需要指出,上述规则是以原始测定值的精度为基础的,对于最终结果的精度,常常要比上述规则确定的有效数字所代表的精度低。通常在有效数字的运算过程中,常多保留一位有效数字,在最终确定计算结果的位数时,仍按上述规则确定。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




