1.层流有限速率模型
层流有限速率模型使用Arrhenius公式计算化学源项,忽略湍流脉动的影响。这一模型对于层流火焰是准确的,但由于湍流火焰中Arrhenius化学动力学的高度非线性,这一模型一般不精确。对于化学反应相对缓慢、湍流脉动较小的燃烧,如超音速火焰是可以接受的。
化学物质i的化学反应净源项通过其参加的NR个化学反应的Arrhenius反应源的和计算得到。

其中,Mw,i是第i种物质的分子量;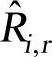 为第i种物质在第r个反应中的产生分解速率。反应可能发生在连续相反应的连续相之间,或是在表面沉积的壁面处,或是发生在一种连续相物质的演化中。
为第i种物质在第r个反应中的产生分解速率。反应可能发生在连续相反应的连续相之间,或是在表面沉积的壁面处,或是发生在一种连续相物质的演化中。
考虑以如下形式写出的第r个反应:

式中,N为系统中化学物质数目;νi′,r为反应r中反应物i的化学计量系数;νi′′,r为反应r中生成物i的化学计量系数;Mi为第i种物质的符号;kb,r为反应r的正向速率常数;kb,r为反应r的逆向速率常数。
式(11-2)对于可逆和不可逆反应都适用。对于不可逆反应,逆向速率常数kb,r简单地被忽略。
式(11-2)中的和是针对系统中的所有物质,但只有作为反应物或生成物出现的物质才有非零的化学计量系数。因此,不涉及的物质将从式中清除。
反应r中物质i的产生/分解摩尔速度以如下公式给出:

式中,Nr为反应r的化学物质数目;Cj,r为反应r中每种反应物或生成物j的摩尔浓度;ηj′,r为反应r中每种反应物或生成物j的正向反应速度指数;ηj′′,r为反应r中每种反应物或生成物j的逆向反应速度指数;Γ表示第三体对反应速率的净影响。
Γ项由下式给出:

其中,rj,r为第r个反应中第j种物质的第三体影响。在默认状态,FLUENT软件在反应速率计算中不包括第三体影响。但是当有它们的数据时,可以选择包括第三体影响。
反应r的在向速率常数kf,r通过Arrhenius公式计算。

式中,Ar为指数前因子(恒定单位);βr为温度指数(无量纲);Er为反应活化能;R为气体常数。
对于FLUENT问题,数据库可以确定提供νi′,r,νi′,′r,ηj′,r,ηj′′,r,βr,Ar,Er,并可选择提供rj,r。
如果反应是可逆的,逆向速率常数kb,r可以根据以下关系从正向速率常数计算。

其中,Kr为平衡常数,从下式计算。

其中,patm表示大气压力(101325Pa)。指数函数中的项表示Gibbs自由能的变化,其各部分按下式计算。
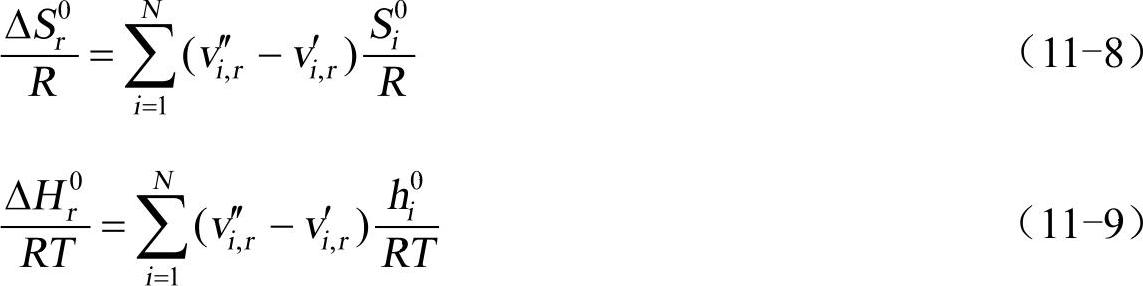
其中,Si0和hi0是标准状态的熵和标准状态的焓(生成热)。这些值在FLUENT软件中作为混合物材料的属性指定。
2.涡耗散模型
该模型下的大部分燃料燃烧速度很快,其反应速率由混合湍流控制。在非预混火焰中,湍流缓慢地通过对流/混合燃料和氧化剂进入反应区,在反应区它们快速地燃烧。在预混火焰中,湍流对流/混合冷的反应物和热的生成物进入反应区,在反应区迅速地发生反应。在这样的情况下,燃烧受到混合限制,过程变得复杂,其中可以忽略掉未知化学反应的动力学速率。
FLUENT软件提供了湍流-化学反应相互作用模型,基于Magnussen和Hjertager的工作,称为涡耗散模型。
反应r中物质i的产生速率Ri,r由下面两个表达式中较小的一个给出。(https://www.xing528.com)

在式(11-10)和式(11-11)中,化学反应速率由大涡混合时间尺度k/ε控制,如同Spalding的涡破碎模型一样。只要湍流出现(k/ε>0),燃烧即可进行,不需要点火源来启动燃烧。这通常对于非预混火焰是可接受的,但在预混火焰中,反应物进入计算区域(火焰稳定器上游)就开始燃烧。实际上,Arrhenius反应速率作为一种动力学开关,阻止反应在火焰稳定器之前发生。一旦火焰被点燃,涡耗散速率通常会小于Arrhenius反应速率,并且反应是混合限制的。
尽管FLUENT软件允许采用涡耗散模型和有限速率/涡耗散模型的多步反应机理(反应数大于2),但可能会产生不正确的结果。原因是多步反应机理基于Arrhenius速率,每个反应都不一样。在涡耗散模型中,每个反应都有同样的湍流速率,因而模型只能用于单步(反应物—产物)或是双步(反应物—中间产物,中间产物—产物)整体反应。模型不能预测化学动力学控制的物质,如活性物质。为合并湍流流动中的多步化学动力学机理,使用EDC模型。
3.LES的涡耗散模型
当使用LES湍流模型时,湍流混合速率(式(11-10)和式(11-11)中的k/ε)被亚网格尺度混合速率替代。计算公式为

4.涡-耗散-概念模型
涡-耗散-概念(EDC)模型是涡耗散模型的扩展,以在湍流流动中包括详细的化学反应机理。它假定反应发生在小的湍流结构中,称为良好尺度。良好尺度的容积比率按下式模拟。

式中,*表示良好尺度数量;Cε为容积比率常数=2.1377;ν为运动粘度。
认为物质在好的结构中,经过一个时间尺度

后开始反应。
其中,Cτ为时间尺度常数,等于0.4082。
在FLUENT软件中,良好尺度中的燃烧视为发生在定压反应器中,初始条件取为单元中当前的物质和温度。经过一个τ*时间的反应后物质状态记为Yi∗。
物质i的守恒方程中的源项计算公式为

EDC模型能在湍流反应流动中合并详细的化学反应机理。但是,典型的机理具有不同的刚性,它们的数值积分计算开销很大。因此,只有在快速化学反应假定无效的情况下才能使用这一模型,如在快速熄灭火焰中缓慢的CO烧尽、在选择性非催化还原中的NO转化。
推荐使用双精度求解器,以避免刚性机理中固有的大指数前因子和活化能产生的舍入误差。
(1)壁面表面反应和化学蒸汽沉积对于气相反应,反应速率是在容积反应的基础上定义的,化学物质的形成和消耗成为物质守恒方程中的一个源项。沉积的速率由化学反应动力和流体到表面的扩散速率控制。壁面表面反应因此在丰富相中创建了化学物质的源(和容器),并决定了表面物质的沉积速率。
FLUENT软件把沉积在表面的化学物质与气体中的相同化学物质分开处理。类似地,涉及沉积的表面反应定义为单独的表面反应,因而其处理也与涉及相同化学物质的丰富相反应不同。表面反应采用的连续方法在高Knudsen数(非常低压力下的流动)下不适用。
(2)颗粒表面反应颗粒反应速率R可以表示为
R=D0(Cg−Cs)=Rc(Cs)N (11-16)
式中,D0为扩散系数;Cg大量物质中的平均反应气体物质浓度(kg/m3);Cs颗粒表面的平均反应气体物质浓度(kg/m3);Rc化学反应速率系数;N显式反应级数(无维)。
在式(11-16)中,颗粒表面处的浓度Cs是未知的,因此需要消掉,表达式改写为

这一方程需要通过一个迭代过程求解,除去N=1或N=0的特例。当N=1时,式(11-17)可以写为

在N=0 情况下,如果在颗粒表面具有有限的反应物浓度,固体损耗速度等于化学反应的速度。如果在表面没有反应物,固体损耗速度根据扩散控制速率突然变化。在这种情况下,出于稳定性的考虑,FLUENT软件采用化学反应速率。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




