1.浓溶液的稀释
质量分数和浓度是溶液稀释计算中最常见的两种。
(1)质量分数wB
【例1-5-3】配制质量分数为18%的稀硫酸480g,需用多少克质量分数为96%的浓硫酸稀释?
解 480g×18%=m×96%
m=480g×18/96=90g
答 需要质量分数为96%的浓硫酸90g。
(2)浓度cB 用水稀释溶液时,溶液的体积增大,浓度相应降低,但溶液中溶质B的物质的量并没有改变。根据溶液稀释前后溶质的量相等的原则,可以得到的稀释规则为
式中 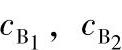 ——B的浓溶液和稀溶液的浓度
——B的浓溶液和稀溶液的浓度
V1,V2——浓溶液和稀溶液的体积。
【例1-5-4】用浓度为18mol/L的浓硫酸溶液,配制500mL浓度为3mol/L的稀硫酸溶液,需浓硫酸多少毫升?
解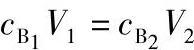
18mol/L×V1=3mol/L×500mL
V1=83.3mL
答 需浓度为18mol/L的浓硫酸83.3mL。(https://www.xing528.com)
2.质量类组成量之间的换算
质量分数和质量摩尔浓度是以质量计量的,把它们归为质量类组成量。根据使用的要求,它们之间的换算举例说明如下。
【例1-5-5】求质量分数为60%的硫酸溶液的质量摩尔浓度。
解 质量分数为60%的硫酸溶液,即每100g溶液中含60g H2SO4,含水40g,所以
答 其质量摩尔浓度为15.3mol/kg。
3.体积类组成量之间的换算
【例1-5-6】试问100g/L的氢氧化钠溶液的浓度cNaOH为多少?
解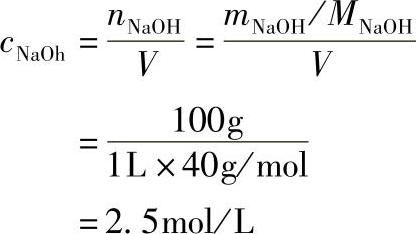
答 100g/L的氢氧化钠溶液的浓度为2.5mol/L。
4.质量类和体积类组成量之间的换算
两类组成量之间相互计算时,必须有一个“媒介”——溶液的密度。借助于密度可以知道溶液的质量和体积的关系。
【例1-5-7】市售浓硫酸的密度ρ=1.84g/mL,质量分数为98%,求其浓度。
解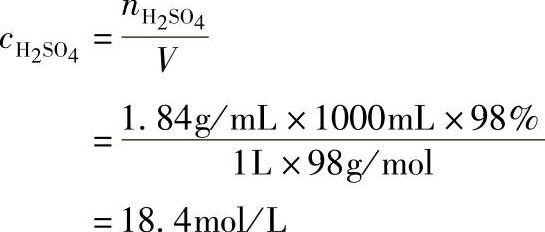
答 其浓度为18.4mol/L。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




