1.概况
注音 shēn
英文 Arsenic
元素符号 As
CAS号 7440-38-2
原子序数 33
元素相对原子质量 74.92
元素类型 类金属
莫氏硬度 3.5
晶体结构 晶胞为三斜晶胞
地壳中的含量 1.5×10-4%
原子体积/(cm3/mol) 13.1
化学键能/(kJ/mol):
As-H 245
As-C 200
As-O 477
As-F 464
As-Cl 293
As-As 348
2.性状
砷是灰色半金属,俗称砒,是一种以有毒著名的类金属,砷有三种同素异形体,呈灰、黄、黑色。工业上用的是在室温下最稳定的灰色晶体,光亮似银,有金属物性,质硬而脆,并善于传热导电,易被捣成粉末。金属砷不溶于水,但溶于硝酸和热硫酸,密度为5.727g/cm3,熔点为817℃(28atm,1atm=101.325kPa)。砷在空气中加热至约200℃时,有荧光出现;到400℃时,会有一种带蓝色的火焰燃烧,并形成白色的氧化砷烟;在空气中加热到613℃时,便可不经液态直接升华,成为蒸气,形成三氧化二砷烟雾,砷蒸气具有一股难闻的大蒜臭味。砷的化合价为+3和+5,第一电离能为9.81eV。游离的砷是相当活泼的,游离元素易与氟和氮化合,在加热情况下也与大多数金属和非金属发生反应。三种有着不同晶格结构的类金属形式砷存在于自然界,严格地说是砷矿和更为稀有的自然砷铋矿和辉砷矿,但更容易发现的形式是砷化物与砷酸盐化合物,总共有数百种的矿物是已被发现的。
自然界中含砷的矿物有雄黄、雌黄、信石等。砷的硫化合物具有强烈毒性,今天砷的拉丁名称arsenium和元素符号As正是由这一词演变而来。
3.用途
砷与其化合物自古以来被用作颜料和杀虫剂、灭鼠药。砷作合金添加剂生产铅制弹丸、印刷合金、黄铜(冷凝器用)、蓄电池栅板、耐磨合金、高强结构钢及耐蚀钢等。高纯砷是制取化合物半导体砷化镓、砷化铟等的原料,也是半导体材料锗和硅的掺杂元素,这些材料广泛用于制作二极管、发光二极管、红外线发射器、激光器等。砷的化合物还用于制造农药、防腐剂、染料和医药等。
砷用于制造硬质合金;黄铜中含有微量砷时可以防止脱锌;砷的化合物可用于杀虫及医疗;三氧化二砷、砷酸盐可作杀虫剂、木材防腐剂;高纯砷还用于半导体和激光技术中。
4.来源及制备
西方化学家一般认为,砷是由德国罗马修道会学者和炼金家马格纳斯(Magnus A,1193—1280)在1250年从含砷矿物中首先制得的。因为他确实在那时用两份肥皂与一份雄黄共炼而制得了单质砷。其实,早在公元四世纪前半叶,中国晋朝大炼丹家葛洪(283—363)已在他的名著《抱朴子·仙药篇》中记载了可以制取单质砷的方法。不过由于原文属提要性质,叙述过于简单,长期以来没有人对它作出解释,因而在化学史上被忽略了。但葛洪所记载的方法有可炼单质砷这一点是确凿无疑的。这是世界上关于炼制单质砷最早的可靠记载,比马格纳斯的工作早九百年以上。
三氧化二砷在我国古代文献中称为砒石或砒霜。小剂量砒霜作为药用在我国医药书籍中最早出现在公元973年宋朝人编辑的《开宝本草》中。到18世纪,瑞典化学家、矿物学家布兰特阐明砷和三氧化二砷以及其他砷化合物之间的关系。拉瓦锡证实了布兰特的研究成果,认为砷是一种化学元素,主要以硫化物矿形式存在,有雄黄(As4S4)、雌黄(As2S3)、砷黄铁矿(FeAsS)等。砷在地壳中的含量约为0.0005%,含量不大,但是它在自然界中到处都有。无论何种金属硫化物矿石中都含有一定量砷的硫化物,因此人们很早就认识到砷和它的化合物。在工厂中,砷是熔炼铅、金、锌、钴、镍的副产品。
砷有三种形式存在,即不带价(As)、三价砷(aesenite)和五价砷(arsenate),其化合物对哺乳动物的毒性由价数的不同,有机或是无机,是气体、液体还是固体,溶解度高低、粒径大小、吸收率、代谢率、纯度等来决定。(https://www.xing528.com)
(1)来源 砷矿主要以硫化物形式存在,主要用于提炼砷元素、制造砷酸和砷的化合物。世界砷矿的主要产地为智利、墨西哥及菲律宾等国,1993年共生产砷元素约3万t。我国砷矿地质勘查大都是在有色金属和贵金属矿产勘查中顺便检查或综合评价的,未进行过系统调查和研究,勘查程度很低,现探明砷元素储量为356万t。青海砷矿资源线索较多,已知矿产地35处,其中中型矿床4处,矿点7处,矿化点24处。已探明砷元素C+D级储量为7.01万t(其中C级为0.53万t),保有储量为6.9万t,潜在价值为1.38亿元,居世界第9位。另有,尕科合、都秀等矿点地质储量为11.8万t。
(2)制备 在自然界中,砷主要以二硫化二砷(雄黄)、三硫化二砷(雌黄)、硫砷化铁等形式存在。图9-8为砷矿,图9-9为自然砷。
1)雄黄(As4S4)、雌黄(As2 S3)是两种天然的含砷矿物,可与氧气发生反应。
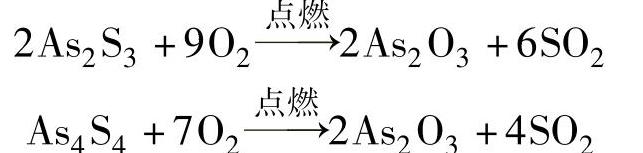
雄黄和雌黄可被Zn、C等在加热条件下还原,得到砷单质。

图9-8 砷矿
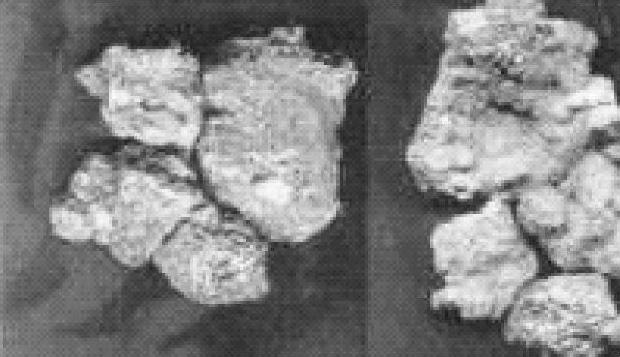
图9-9 自然砷
2)砷化氢是无色有毒气体,相对分子质量为77.9454,不稳定,可发生可逆反应。
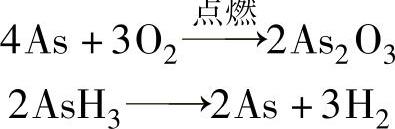
3)砷化氢是强还原剂,很容易被氧化,与氧气反应(自燃)。

4)砷化氢与氨气不同,一般不显碱性,可以用于半导体材料砷化镓在700~900℃的化学气相沉积。
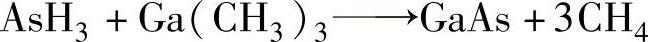
5)三氧化二砷是毒性很强的物质,砒霜的主要成分,可用于治疗癌症,是两性氧化物,可被一些强氧化剂氧化成五价砷。
被臭氧氧化:
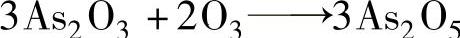
被氟气氧化: (此反应用于制取高纯度的AsF5)
(此反应用于制取高纯度的AsF5)
6)三氧化二砷可被过氧化氢氧化成砷酸。
五价砷的卤化物只有五氟化砷能稳定存在,是无色气体,发生水解反应,生成氟化氢(腐蚀玻璃的原理)。五氧化二砷是酸性氧化物,溶于水能生成三种砷酸(偏砷酸、砷酸和焦砷酸)。砷酸(H3AsO4)与磷酸性质相似,其钾、钠、铵盐溶于水,其他盐一般不溶于水。
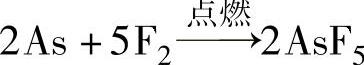
5.危害及防治
微量的砷是动物生理所需要的。在雏鸡、仓鼠、山羊、猪和大白鼠实验中,砷缺乏最一致的表现是生长抑制和生殖异常。生殖异常特征是受精能力损伤和围产期死亡率的增加,所有物种在缺砷时都表现出各种器官内矿物质含量的变化,对砷缺乏的某些应答反应取决于应激因子或其他因素的存在。人的砷需要量为6.25μg/4.18MJ~12.5μg/4.18MJ,世界各地砷的摄入量一般为12~40μg,摄入海产品多的人,砷的摄入量可达到每天195μg。鱼、海产品、谷类、酒和粮食制品是砷的主要膳食来源。膳食中各种砷很容易被吸收。鱼、海产品、藻类中含有砷胆碱(arsenocholine),这些化合物对人体毒性低而且容易排出体外。
膳食中无机砷酸盐和亚砷酸盐水溶液中的砷有90%以上可被吸收,不同形式的有机砷其砷的吸收程度不一样,代表去毒的甲基化多半在肝脏进行,甲基化的能力会因砷暴露量增加而降低。然而,甲基化的能力是可以被训练的,若长时间暴露在低浓度的砷中,之后再暴露在高浓度砷中,则甲基化能力会增强。无机砷在肝脏经甲基化后主要代谢为二甲砷酸,经由肾脏、排汗、皮肤脱皮或指甲头发等排出。在人体内,五价砷和三价砷会互相转换,而海产品中的砷化物无法在人体内转化,通常也以原貌由尿液排出。膳食中的无机砷通常在两天内排出。
(1)危害 含砷矿石的开采和冶炼,以砷化合物为原料的玻璃、颜料、药物、纸张、半导体等的生产以及煤的燃烧,均可能造成砷对环境的污染。砷主要通过呼吸道、消化道和皮肤接触进入体内,砷进入人体内被吸收后,将破坏细胞的氧化还原能力,影响细胞正常代谢,引起组织损害和机体障碍,可直接引起中毒死亡。如果将砷作用于人体局部,最初有刺激症状,久之出现组织坏死。砷对黏膜具有刺激作用,可直接损害毛细血管。自然界的砷多为五价化合物,污染环境的砷多为三价化合物。三价砷在体内的蓄积性和毒性均较五价砷大。砷的毒性与其化合物有关,无机砷氧化物及含氧酸是最常见的砷中毒原因。当砷的摄入量超过排泄量时,经黏膜或皮肤吸收的砷及化合物,就会在毛发、指甲、骨、肝、肾、肺、脾等器官,特别是毛发、指甲中蓄积。
(2)防治
防止工业砷污染的根本措施是改革工艺,对含砷的废水、废气和废渣加以综合利用。与此同时,还须制定标准,控制砷化物在环境中的浓度。我国有的地区地下矿产中有较高的含砷量,在进行地下水资源利用工程施工前应有预防性环境医学监测。对砷中毒患者除采用二巯基丙磺酸钠、二巯基丁二酸钠等解毒药和对症治疗外,还应脱离砷污染环境,以利于疾病的治疗。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




