1.配制标准溶液的一般方法
配制标准溶液的一般方法有两种,即直接配制法和标定法(间接配制法)。
(1)直接配制法 准确称取一定量的基准试剂,溶解后,在校正过的容量瓶中稀释到准确体积,由所称取基准物质的质量和所配成溶液的准确体积,即可计算出该标准溶液的准确浓度。
(2)标定法 许多化学试剂不符合基准试剂的要求,如氢氧化钠、盐酸、高锰酸钾等,因而这些试剂的标准溶液不能采用直接法配制,而必须采用间接法即标定法配制。即根据所需要的浓度和体积,计算出应称量的固体溶质的质量或应量取的液体溶质的体积,先配制成接近所需浓度的溶液,然后用基准试剂或另一种已知准确浓度的标准溶液来测定其准确浓度,这个操作过程称为标定。标定方法有两种:
1)用基准试剂标定:称取一定量的基准试剂,溶解后用待标定的溶液滴定,根据基准试剂的质量、摩尔质量及消耗标定溶液的体积,即可计算出该溶液的准确浓度。
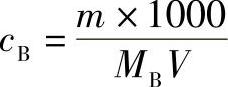
式中 cB——被标定溶液的物质的量浓度(mol/L);
m——称取基准试剂的质量(g);
MB——基准试剂的摩尔质量(g/mol);
V——消耗被标定溶液的体积(mL)。
例11 用基准试剂邻苯二甲酸氢钾标定0.10mol/LNaOH标准溶液的准确浓度。
标定方法:称取已在110℃干燥2h的邻苯二甲酸氢钾m1=0.3992g、m2=0.4001g、m3=0.3991g,分别置于300mL的锥形瓶中,溶于100mL水中,加热至沸,滴加酚酞指示剂(1%乙醇溶液)2滴或3滴,立即用待标定的NaOH溶液滴定至微红色为终点,消耗NaOH溶液的体积分别为V1=19.93mL、V2=20.00mL、V3=19.93mL。
解 用NaOH滴定KHC8H4O4的反应方程式为
KHC8H4O4+NaOH=KNaC8H4O4+H2O
选定NaOH为基本单元,邻苯二甲酸氢钾的摩尔质量M(KHC8H4O4)=204.22g/mol。
因此

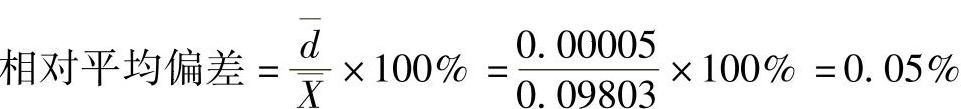
由于相对平均偏差0.05%小于0.2%(允许偏差),符合要求,所以,NaOH标准溶液的物质的量浓度取三次测定结果的算术平均值为
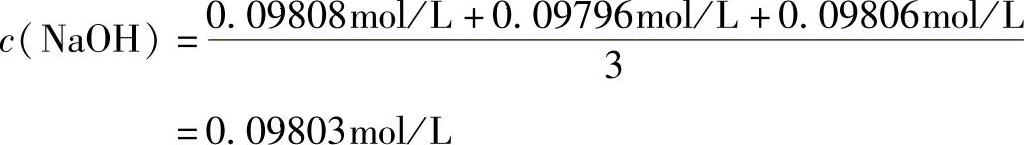
2)用已知浓度的标准溶液标定(比较法):准确吸取一定量的待标定溶液,用已知准确浓度的标准溶液滴定,或准确吸取一定量的标准溶液,用待标定溶液滴定。根据两种溶液的体积及标准溶液浓度,即可算出待标定溶液的准确浓度。这种标定方法也称为比较法。
依据等物质的量规则,比较法计算公式为
cBVB=cAVA
式中 cB——待标定溶液的物质的量浓度(mol/L);(https://www.xing528.com)
VB——待标定溶液的体积(L);
cA——标准溶液的物质的量浓度(mol/L);
VA——标准溶液的体积(L)。
有时,在标定过程中,不需计算出准确浓度,只需求出体积比系数(f)即可(一般在返滴定分析中采用)。
例12 用已知浓度c[Pb(NO3)2]=0.01200mol/L的标准溶液,标定浓度为0.01mol/L的EDTA溶液。
标定过程:用滴定管量取Pb(NO3)2标准溶液 、
、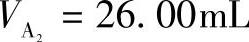 、
、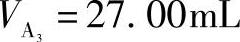 ,分别置于300mL锥形瓶中,加水约60mL、缓冲溶液(pH=5.5)10mL、二甲酚橙指示剂(0.2%)2滴,用待标定的EDTA溶液滴定至溶液呈黄色为终点,消耗EDTA溶液的体积分别为
,分别置于300mL锥形瓶中,加水约60mL、缓冲溶液(pH=5.5)10mL、二甲酚橙指示剂(0.2%)2滴,用待标定的EDTA溶液滴定至溶液呈黄色为终点,消耗EDTA溶液的体积分别为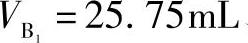 、
、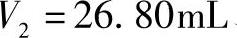 、
、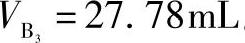 。
。
解
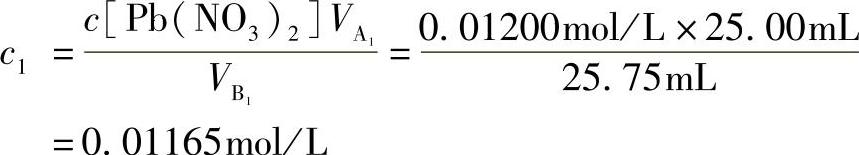
同理: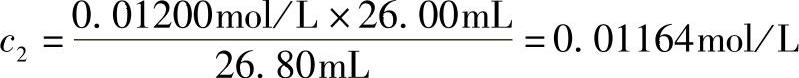
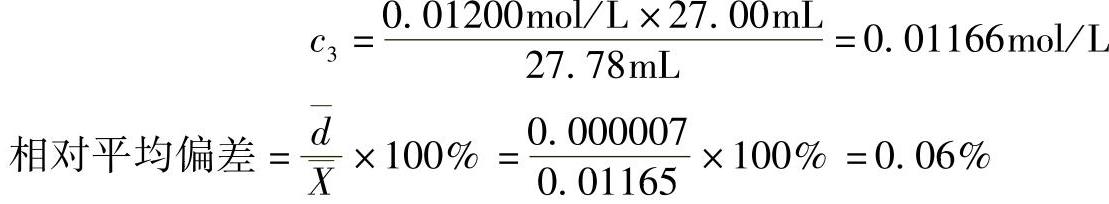
由于相对平均偏差0.06%<0.2%(允许偏差),符合标定要求,因此,EDTA溶液的物质的量浓度为
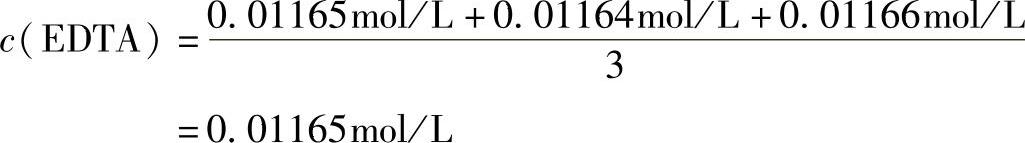
标定时一般不宜取相同体积的溶液,可间隔1~2mL,这样有利于避免主观误差。
在实际工作中,还可直接用被测组分的标准溶液或标准物质测其滴定度,这样可使标定条件与测定条件基本相同,有利于消除共存元素的影响和某些操作误差,更符合实际情况。但必须指出的是,所选用的标准物质,其组成成分应与待测样品相似,而待测定的组分含量应与待测样品中该成分的含量相近,这样才能获得满意的效果。不过标准溶液的标定一般应尽量采用直接标定法。
2.配制标准溶液的一般规定
标准溶液的配制,对于化学分析结果的准确度来说,是一个基本的非常重要的因素,必须认真对待,不得马虎从事。现将实际操作过程中的有关注意事项介绍如下:
1)配制和标定溶液所用的量器(滴定管、移液管、容量瓶等)必须确保质量,必要时要进行校正。
2)称取基准试剂的质量不应太少(不少于0.2g),必须用足够精度的分析天平称量。标定时,所用标准溶液的体积也不应太少,一般在25mL左右,标准溶液浓度与待标定溶液近似浓度应相近。
3)标定时至少应平行操作3次,相对平均偏差不应超过0.2%,取算术平均值计算。
4)用直接称量基准试剂进行标定,一般适用于浓度大于0.1mol/L的溶液。标定稀溶液,可用基准试剂的标准溶液进行。
5)需经常使用且大量配制的标准溶液,可先配成较浓的溶液作为储备液(母液),使用时再稀释成所需浓度并在标定后使用。
6)溶液配毕或标定结束后应立即贴上标签,注明标准溶液的名称、规格、浓度、配制或标定日期、配制人等。若用非水溶剂配制,还需注明溶剂名称及其浓度。
7)配好的溶液应按要求存放在合适的位置,如见光易分解的AgNO3、KMnO4等应储于棕色瓶中并放于暗处;能吸收空气中CO2并能腐蚀玻璃的强碱溶液,应装在塑料瓶中,并在瓶口处装一支苏打石灰管以吸收空气中的CO2和水。若用玻璃瓶,则要用橡胶塞,而不能用磨口塞。其他溶液一般可用磨口玻璃瓶存放。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




