在此介绍萃取分离-EDTA滴定法。
(1)方法提要 试样用盐酸-过氧化氢溶解,在c(HCl)=0.1~0.8mol/L的盐酸介质中,锌以硫氰酸盐络离子状态被甲基异丁基酮(MIBK)定量萃取,使锌与大量铝、锰、镍、铜、铁等元素分离(加入硫脲,可掩蔽铜、银,用氟化物掩蔽铁),用pH=5.5的六次甲基四胺缓冲溶液返萃取,只使锌进入水相,即可进行锌的络合滴定。
(2)主要试剂
1)缓冲溶液(pH=5.5):称取100g六次甲基四胺,溶于水中,加20mL盐酸,用水稀释至500mL。
2)EDTA标准溶液(0.01000mol/L):用基准试剂配制。
3)洗涤液:移取10mL硫氰酸铵溶液(50%),加2mL盐酸,加水至100mL。
(3)分析步骤 称取0.5000g试样,置于100mL两用瓶中,加入20mL盐酸(1+1),待剧烈反应停止后滴加过氧化氢(3%),使铜元素溶解,(硅含量高的试样还需滴加氢氟酸助溶),溶解完毕后煮沸1min左右,以分解多余的过氧化氢,冷却,用水稀释至刻度。
移取20mL试液,置于125mL具有刻度的分液漏斗中,加入过量的硫脲溶液(5%),使铜(Ⅱ)完全掩蔽,加水约70mL,加10mL硫氰酸铵溶液(50%),摇匀,加20mLMIBK溶液,振荡萃取1~2min,静置分层后,弃去水相,于有机相中加入15mL洗涤液及5mL氟化铵溶液(20%),振摇1min,分层后弃去水相,再重复1次或2次,将有机相放入250mL烧杯中,用20mLpH=5.5的缓冲溶液及50mL水洗涤分液漏斗,将洗液并入烧杯中,加5mL硫脲溶液(5%)、5mL氟化铵溶液(20%),摇匀,加数滴二甲酚橙指示剂(0.2%),用EDTA标准溶液滴定至溶液由紫红色转变为纯黄色为终点。
(4)结果计算 锌的质量分数的计算公式为
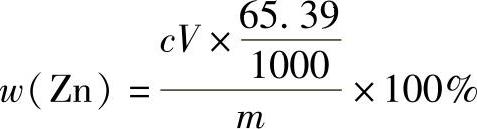 (https://www.xing528.com)
(https://www.xing528.com)
式中 c——EDTA标准溶液的浓度(mol/L);
V——测定时所消耗的EDTA标准溶液的体积(mL);
m——试样的质量(g);
65.39——锌的摩尔质量(g/mol)。
(5)附注
1)溶解试样时,如果作用十分剧烈,应立即置于冷水中冷却,以免溶液冲溅。
2)第一次萃取时只加硫脲掩蔽铜,而不加氟化物掩蔽铁,以免产生大量的氟化铝沉淀而使萃取失败。这时铁(Ⅲ)与锌(Ⅱ)一起进入有机相,然后用氟化物的洗液洗涤有机相,除去铁(Ⅲ)。
3)MIBK萃取时,少量镉(Ⅱ)也能被萃取,但用pH=5.5的缓冲溶液返萃取时,锌立即返回水相,而镉仍留在有机相中。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




