1.氧化法
(1)原理 在低温条件下,样品中的游离二氧化硫与过量的过氧化氢反应生成硫酸,再用碱标准溶液滴定生成的硫酸,由此可得到样品中游离二氧化硫的含量。在加热条件下,样品中的结合二氧化硫被释放,与过氧化氢发生氧化还原反应,通过用氢氧化钠标准溶液滴定生成的硫酸,可得到样品中结合二氧化硫的含量。将结合二氧化硫的含量与游离二氧化硫的含量相加,即得出样品中总二氧化硫的含量。
(2)仪器与试剂
1)仪器:真空泵、二氧化硫测定装置(见图2-3-10)。
2)试剂:过氧化氢(分析纯)、磷酸(分析纯)、氢氧化钠(分析纯)、甲基红指示剂、次甲基蓝指示剂。其他试剂如下:
①过氧化氢溶液(0.3%):吸取1mL30%过氧化氢(开启后存于冰箱中),用水稀释至100mL,使用当天配制。
②磷酸溶液(25%):量取295mL85%磷酸,用水稀释至1000mL。
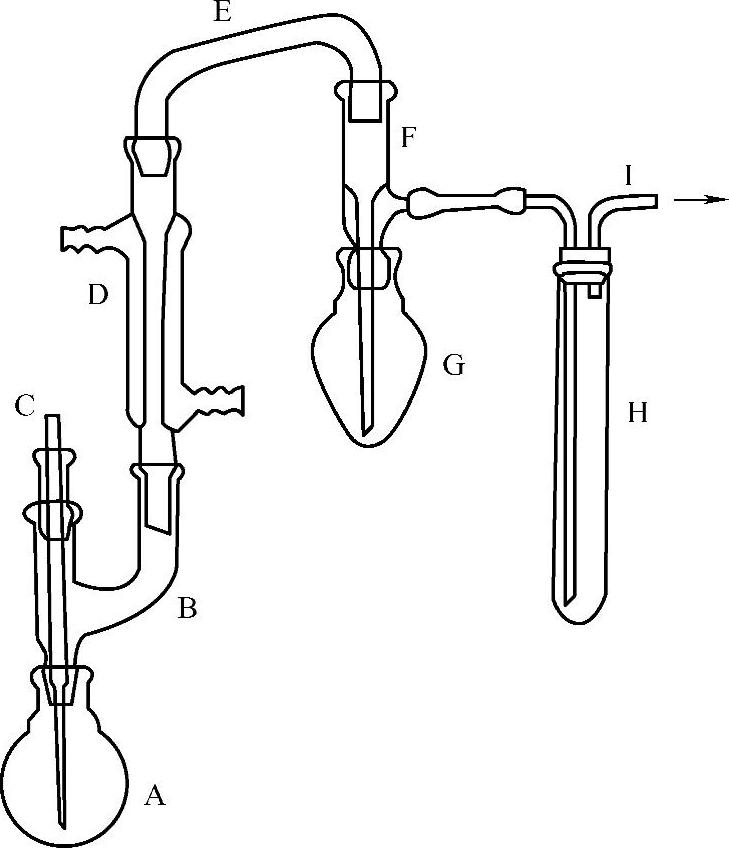
图2-3-10 二氧化硫测定装置示意图
A—短颈球瓶 B—三通连接管 C—通气管 D—真空冷凝管 E—弯管 F—真空蒸馏接收管 G—梨形瓶 H—气体洗涤器 I—直角弯管(接真空泵或抽气管)
③氢氧化钠标准溶液(0.01mol/L):称取120g氢氧化钠,加100mL水,振摇使之溶解成饱和溶液,冷却后置于聚乙烯塑料瓶中,密塞,放置数日,吸取5.6mL澄清的氢氧化钠饱和溶液,加适量新煮沸的冷水稀释至1000mL,摇匀,存放在橡胶塞上装有钠石灰管的瓶中,使用前稀释10倍,必要时用盐酸标定,每周重配。
④甲基红-次甲基蓝混合指示液
a.溶液Ⅰ:称取0.1g次甲基蓝,溶于乙醇(体积分数为95%),用乙醇(体积分数为95%)稀释至100mL。
b.溶液Ⅱ:称取0.1g甲基红,溶于乙醇(体积分数为95%),用乙醇(体积分数为95%)稀释至100mL。
c.取50mL溶液Ⅰ、100mL溶液Ⅱ,混匀。
(3)操作步骤
1)游离二氧化硫的测定
①按图2-3-10所示,将二氧化硫测定装置连接妥当,直角弯管与真空泵(或抽气管)相接,直管冷凝管通入冷却水,取下梨形瓶和气体洗涤器,向梨形瓶中加入20mL过氧化氢溶液,向气体洗涤器中加入5mL过氧化氢溶液,各加3滴混合指示液后,溶液立即变为紫色,滴入氢氧化钠标准溶液,使其颜色恰好变为橄榄绿色,然后重新安装妥当,将短颈球瓶浸入冰浴中。
②吸取20.00mL样品(液温为20℃±0.1℃),从通气管上口加入短颈球瓶中,随后吸取10mL磷酸,也从通气管上口加入短颈球瓶中。
③开启真空泵,使抽入空气的流量为1000~1500mL/min,抽气10min,取下梨形瓶,用氢氧化钠标准溶液滴定至重现橄榄绿色即为终点,记下消耗氢氧化钠标准溶液的体积。以水代替样品做空白试验,操作同上。一般情况下,气体洗涤器中溶液不应变色,如果溶液变为紫色,也需要用氢氧化钠标准溶液滴定至橄榄绿色,并将所消耗氢氧化钠标准溶液的体积与梨形瓶消耗氢氧化钠标准滴定溶液的体积相加。
④结果计算:试样中游离二氧化硫的含量按式(2-3-77)进行计算。
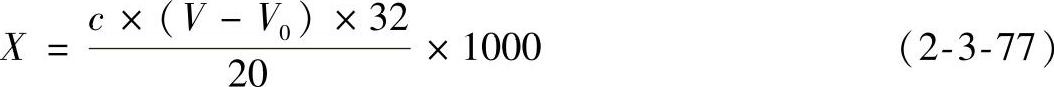
式中 X——样品中游离二氧化硫的含量(mg/L);
c——氢氧化钠标准溶液的浓度(mol/L);
V——测定样品时消耗氢氧化钠标准溶液的体积(mL);
V0——空白试验消耗氢氧化钠标准溶液的体积(mL);
32——二氧化硫的摩尔质量(g/mol);(https://www.xing528.com)
20——吸取样品的体积(mL)。
计算结果保留三位有效数字。
⑤精密度:在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
2)结合二氧化硫的测定
①继上述测定游离二氧化硫后,将滴定至橄榄绿的梨形瓶重新与真空蒸馏接收管连接,拆除短颈球瓶下的冰浴,用温火加热短颈球瓶,使瓶内溶液保持微沸。
②开启真空泵,使抽入空气的流量为1000~1500mL/min,抽气10min,取下梨形瓶,用氢氧化钠标准溶液滴定至重现橄榄绿色即为终点,记下消耗氢氧化钠标准溶液的体积。以水代替样品做空白试验,操作同上。一般情况下,气体洗涤器中溶液不应变色,如果溶液变为紫色,也需要用氢氧化钠标准溶液滴定至橄榄绿色,并将所消耗氢氧化钠标准溶液的体积与梨形瓶消耗氢氧化钠标准溶液的体积相加。
③计算:同游离二氧化硫的测定,计算结果为结合二氧化硫的含量。
④结果计算:将游离二氧化硫与结合二氧化硫测定值相加,即为样品中总二氧化硫的含量。
2.直接碘量法
(1)原理 在碱性条件下,结合态二氧化硫被解离出来,然后再用碘标准溶液滴定,得到样品中总二氧化硫的含量。
(2)仪器与试剂
1)仪器:碘量瓶(250mL)、电炉子、吸管、酸式滴定管等。
2)试剂:氢氧化钠溶液(100g/L)、(1+3)硫酸溶液(取1体积浓硫酸缓慢注入3体积水中)。其他试剂如下:
①碘标准溶液[c(1/2I2)=0.02mol/L]:称取13g碘及35g碘化钾,溶于100mL水中,稀释至1000mL,摇匀,储存于棕色瓶中,标定后,再准确稀释5倍。
②淀粉指示剂(10g/L):称取1g可溶性淀粉,加入5mL水,搅匀后缓缓倾入90mL沸水中,随加随搅拌,煮沸2min,放冷稀释至100mL,再加入40g氯化钠。其使用期为两周。
(3)测定步骤 吸取25.00mL氢氧化钠溶液置于250mL碘量瓶中,再准确吸取25.00mL样品(液温为20℃),并以吸管插入氢氧化钠溶液的方式加入到碘量瓶中,摇匀,盖塞,静置15min后,再加少量碎冰块、1mL淀粉指示剂、10mL硫酸溶液,摇匀,用碘标准溶液迅速滴定至淡蓝色,30s内不变即为终点,记下消耗碘标准溶液的体积(V)。
以水代替样品做空白试验,操作方法同上。
(4)结果计算 样品中总二氧化硫的含量按式(2-3-78)计算。
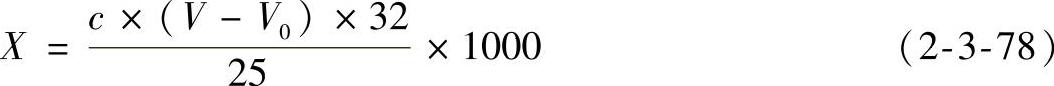
式中 X——样品中总二氧化硫的含量(mg/L);
c——碘标准滴定溶液的浓度(mol/L);
V——测定样品时消耗碘标准溶液的体积(mL);
V0——空白试验消耗碘标准溶液的体积(mL);
32——二氧化硫的摩尔质量(g/mol);
25——吸取样品的体积(mL)。
计算结果保留三位有效数字。在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




