正如式(7-33)表明的,在电极上同时进行着方向相反的反应,一个是金属离子M+(液相)得到电子生成金属M,即
M+(液相)+e(固相)=M (7-162)另一个是逆向反应
M=M+(液相)+e(固相) (7-163)
当两个反应速率相等时,达到平衡电极电位φe。式(7-162)表示的得电子的反应叫做阴极反应(cathode reaction)。式(7-163)表示的失电子的反应叫做阳极反应(anode reaction)。阴极反应即阴极还原。阳极反应即阳极氧化。
用i-表示反应式(7-162)的电流密度,i+表示反应式(7-163)的电流密度(图7-11)。
当达到平衡电极电位φe时,如图7-12a所示。

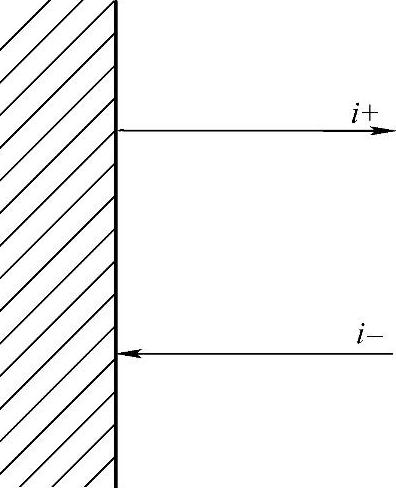
图7-11 阴极还原和阳极氧化的电流密度
io称为交换电流密度(exchange cur-rent density)。io必须有足够大的值,否则不易建立稳定的平衡电极电位。Pb的交换电流密度较大。交换电流密度与溶液中的离子浓度成正比关系。如果离子浓度过低(如<10-8M),io太小,也不易建立平衡电极电位。
如果把上述金属电极与另一电极组成电池,并接上外电路,电极上有(净)电流通过,电极电位如何变化呢?
假定外电路接通后该电极上有电子流入金属相。此时金属——溶液界面上的离子M+(液相)将部分得到电子而生成固相金属,即加速了反应式(7-162)。由于电子流入引起电极电位降低,同时抑制了电子继续流入,直至离子M+(液相)得到电子的反应速率与流入电子的速率相等,建立起稳定的电极电位。此时i->i+,电极电位比平衡电极电位φe变负,即φ<φe,电极上有电子过剩,有电子净发射至溶液中,即有得电子的净阴极电流ic流过(见图7-12b)。
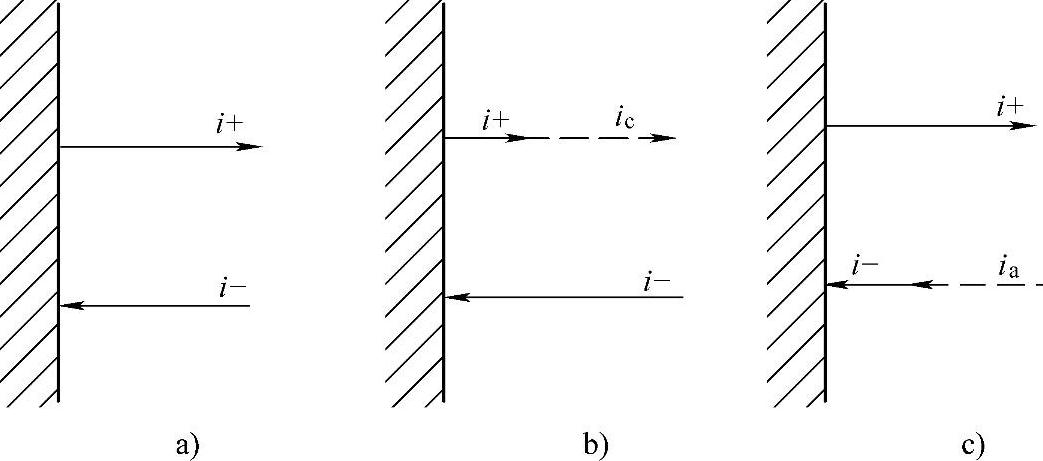
图7-12 净阴极电流和净阳极电流
a)i+=i-时达到平衡电极电位 b)i->i+时电极电位变负 c)i+>i-时电极电位变正
此时,ic=i--i+,阴极过电位Δφc=φ-φe<0为负值。
相反,当外电路接通后有电子流出金属相时,金属—溶液界面上将有部分金属原子失去电子进入溶液而变为离子M+(液相)即加速了反应(见式(7-163))。由于电子流出引起电极电位升高,同时抑制了电子的继续流出,直至金属原子M变为离子M+(液相)的反应速率与流出电子的速率相等,建立起稳定的电极电位。此时i+>i-,电极电位比平衡电极电位φe变正,即φ>φe,(https://www.xing528.com)
电极上有过剩的正电荷,有带有正电荷的离子进入溶液,即有失
电子的净阳极电流ia流过(见图7-12c)。
此时,ia=i+-i-,阳极过电位Δφa=φ-φe>0为正值。
过电位与净电流的关系如图7-13所示。
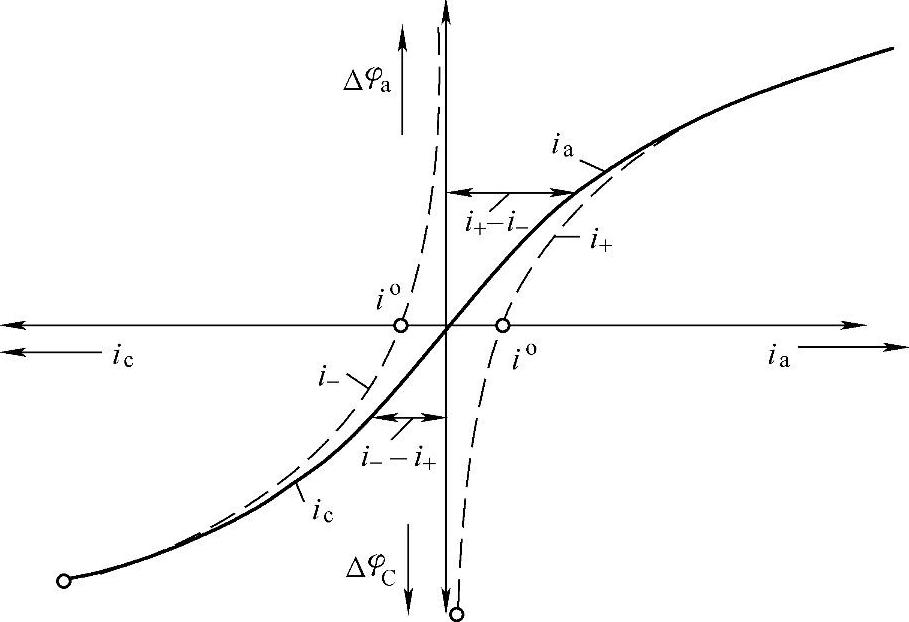
图7-13 过电位与净电流的关系
研究氢和氧分别在铅及其合金上的阴极和阳极过电位对铅酸蓄电池有重要意义。铅酸蓄电池的自放电在很大程度上与氢过电位有关。极板化成或电池内化成与充电的副反应就是分别在负极和正极上析出氢气和氧气的反应。
在过电位的绝对值远大于25mV(即RT/F)的电流密度区域,过电位Δφ与电流密度i的关系服从由实验数据得到的经验方程
︱Δφ︱=a+blni (7-164)式(7-164)称为塔菲尔(Tafel)方程。式中常数a,即i=1A·dm-2时的过电位值,依赖于电极金属的性质、它的表面状态、溶液组成和温度。常数b随着电极性质的变化通常变化不大。这里i、a和b的值都取正号。
在过电位的绝对值很小时,式(7-164)显然不适用。随着i降至趋近于零,Δφ也应趋近于零,而不是像从式(7-164)得出的那样趋近于负无穷。在过电位的绝对值较小时,存在着线性关系
︱Δφ︱=ki (7-165)常数k依赖于金属性质和其它因素。
︱Δφ︱随着温度的升高而降低。在阐明过电位机理的表达式中,常把塔菲尔方程写成

这里α对大多数金属来说是一个接近0.5的常数。式(7-166)对温度T求导数,就可以写成
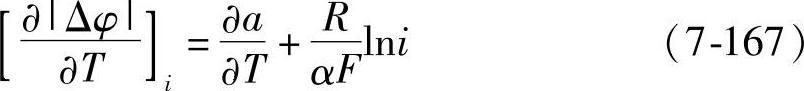
因为∂a/∂T<0,所以在i较小时∂|Δφ|/∂T的值比较大,而在i较大时则比较小。这就是过电位的温度系数∂|Δφ|/∂T的变化的大致规律,这里的符号T表示热力学温度。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




