烟火药燃烧时放出的热量决定着其特种效应。在一定条件下,1 g烟火药燃烧时放出的热量称为烟火药的燃烧热,以“kJ/g”表示。获得烟火药燃烧热的方法有基于盖斯定理的理论计算法和利用量热计测量的试验法两种。这里介绍基于盖斯定理的理论计算法。
试验证明,不管化学反应是一步完成的,还是分几步完成的,该反应的热效应相同。换言之,反应热效应只与起始状态和终了状态有关,与反应的途径无关,这就是盖斯定律。根据热力学第一定律,因为焓是状态函数,只要化学反应的起始状态和终了状态给定,则反应的热效应就是定值,与通过的具体途径无关。烟火药一般是在大气中燃烧(可以看成是定压),用盖斯定律计算是有意义的。
利用盖斯定律计算烟火药燃烧热的示意图如图5.8所示。图中状态1(初态)相当于组成烟火药各组分的元素,状态2相当于烟火药,状态3(终态)相当于燃烧产物。设想有两条途径,一条由元素得到烟火药,同时放出或吸收热量为Q12(药剂各成分生成热),然后烟火药燃烧并放出热量Q23(烟火药的燃烧热);另一途径是由元素直接生成燃烧产物,同时放出热量Q13(燃烧生成物的生成热)。根据盖斯定律,沿第一条途径转变时,反应热的代数和应等于沿第二条途径转变时反应热,即Q12+Q23=Q13,移项,有Q23=Q13-Q12,所以烟火药的燃烧热等于燃烧产物的生成热减去药剂各成分的生成热。

图5.8 计算烟火药燃烧热的盖斯三角形
一般烟火药在大气中燃烧时速度较小,根据这一点可以认为燃烧是在定压下进行的。烟火药燃烧热Qp与炸药分解热的计算不同,炸药的分解热是用等容热QV表示,只有烟火药爆炸分解时才相似,所以二者数值不相等。如果燃烧生成的气体产物视为理想气体,Qp与QV关系为:
![]()
式中,Δn——气态产物和气态反应物之差;
T——反应的热力学温度。
烟火药中一些常用化合物在25℃下的生成热见表5.1。
表5.1 烟火药中常用化合物的生成热

例5.1 求Ba(NO3)2和Al粉二元混合物的燃烧热。
解:首先写出燃烧反应方程式:(https://www.xing528.com)
![]()
因为单质的生成热为0,故烟火药燃烧总热量为:

Ba(NO3)2及铝的总质量为:
![]()
药剂的燃烧热为:
![]()
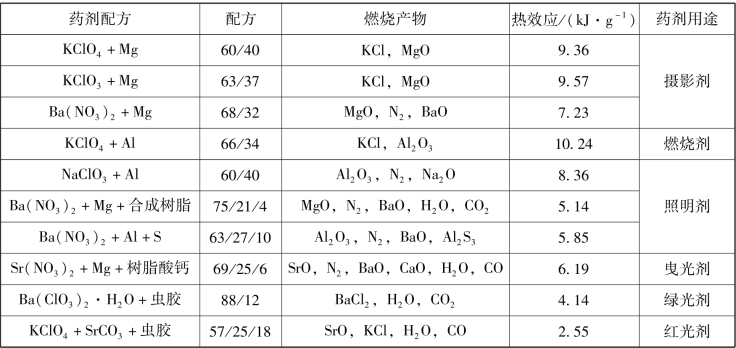
某些光效应烟火药的热效应见表5.2,它是按盖斯定律计算的零氧平衡药剂的热值。假如不算类似镁、铝及其合金一类借空气中氧燃烧的药剂,摄影剂燃烧热最大,其次是照明剂和曳光剂,燃烧时放热量最少的是发光信号剂。一些负氧差药剂在燃烧过程中有空气参加,其燃烧热比零氧平衡药剂要大。
表5.2 某些光效应烟火药的热效应
例如,44%KClO3+56%Mg,氧差n=-20 g O2时燃烧反应方程式为:
![]()
经计算,该药剂燃烧热为14.1 kJ/g,与零氧平衡的同药剂相比,燃烧热增加了49%。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




