1.序列丰富度和多样性分析
本研究首先将3个恩施地区酸菜水进行16s rRNA测序,其结果及各分类地位数量如表2-7所示。
表2-7 样品16s rRNA测序情况及各分类地位数量
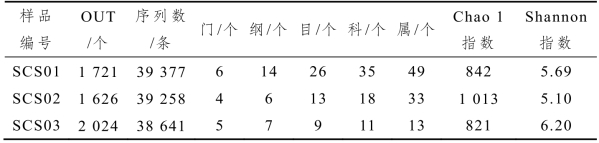
注:计算每个样品Chao1和Shannon指数时,样品的测序量均为30 510条序列。
本研究采集的3个酸菜水样品共产生了117 276条16s rRNA序列。根据100%的相似性进行序列划分共得到60 342条代表性序列,根据序列的97%相似性进行OTU划分后,共得到4 473个OTU,每个样品平均1 419个。由表2-7可知,SCS02样品具有最大的细菌物种丰度,其Chao 1指数为1 013,而SCS03样品细菌多样性最高,其Shannon指数为6.20。
2.基于不同分类地位酸菜水样品核心细菌菌群相对含量分析
纳入本研究的序列被鉴定为7个门、15个纲、29个目、38个科和58个属,其中只有0.37%的序列不能鉴定到属水平。本研究的3个酸菜水样品中平均相对含量>1%的细菌门分别为硬壁菌门(Firmicutes)和变形菌门(Proteobacteria),其相对含量分别为97.78%和1.96%。值得一提的是,3个样品中隶属于硬壁菌门(Firmicutes)的细菌相对含量分别为98.10%、95.28%和99.95%。基于属水平3个酸菜水样品中优势细菌的相对含量如图2-11所示。

图2-11 酸菜水中优势细菌属相对含量的比较分析
由图2-11可知,优势细菌属分别为隶属于硬壁菌门(Firmicutes)的乳酸杆菌属(Lactobacillus)和片球菌属(Pediococcus),其平均相对含量分别为76.25%和15.80%。通过采用454焦磷酸测序技术,李欣蔚对16份东北传统自然发酵酸菜汁样品中细菌多样性进行了解析,研究发现厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为其优势细菌门,而乳杆菌属(Lactobacillus)、假单胞菌(Pseudomonas)和明串珠菌属(Leuconostoc)为其优势菌属[18]。利用构建16s rRNA基因文库的方法,曹碧璇对辽宁地区农家自然发酵酸菜液中的微生物多样性进行了研究,结果发现乳酸杆菌属(Lactobacillus)、片球菌属(Pediococcus)和枸橼酸杆菌属(Citrobacter)是酸菜发酵液中的优势菌[19]。利用Illumina高通量测序技术,佟婷婷对四川农家泡菜中的细菌多样性进行了研究,结果发现四川地区泡菜中的优势菌是乳杆菌属(Lactobacillus),且含量达到80%~85%[20]。利用PCR-DGGE技术,乌日娜对东北地区发酵酸菜中的微生物多样性进行解析时发现乳酸杆菌属(Lactobacillus)为其中的优势细菌属[21]。由此可见,虽然不同地区制作酸菜的工艺和原料不同,但是乳酸杆菌均为其优势细菌属。
本研究进一步统计了OTU在3个样品中出现的次数,结果发现出现1次和2次的OTU分别为3 759和530个,分别占OTU总数的84.04%和11.85%,所包含序列数为8 946和25 678条。同时核心OTU为184个,占OTU总数的4.11%,所包含序列数82 437条,经分析发现在184个核心OTU之中有11个OTU的相对含量大于1%。本研究进一步对11个核心OTU在3个酸菜水样品中的相对含量进行了分析,结果如图2-12所示。

图2-12 平均相对含量大于1.0%的核心OTU在酸菜水样品中相对含量的热图
由图2-12可知,在11个核心OTU中,10个隶属于乳酸杆菌属(Lactobacillus),只有OTU3578隶属于片球菌属(Pediococcus),11个核心OTU的累计相对含量达47.68%。部分OTU在3个样品中的相对含量差异较大,其中OTU3578在SCS01和SCS02中相对含量分别为5.24%和5.69%,而在SCS03中的相对含量为27.17%;OTU1679在SCS01和SCS02中相对含量分别为0.77%和0.17%,而在SCS03中的相对含量为19.27%。
3.酸菜水中乳杆菌DGGE图谱及系统发育分析(https://www.xing528.com)
在对酸菜水样品进行Miseq高通量测序后,本研究进一步使用PCR-DGGE技术对3个样品乳酸杆菌属多样性进行了分析。由于不同样品乳酸杆菌的群落结构不同,在变性梯度凝胶电泳后会分离出数目不等的条带。分离出的条带数目越多,说明样品微生物多样性越丰富,同时各条带的亮度在一定程度亦能说明微生物的丰度存在差异[22]。酸菜水中乳酸杆菌PCR-DGGE电泳图如图2-13所示。
由图2-13可知,指纹图谱中共有8条条带较为明亮,其中条带3和4在所有样品中均存在,但亮度不一致;条带6和8存在于SCS01和SCS02中,亮度亦不一致;条带1仅存在于SCS02样品中,条带2仅存于在SCS01样品中,条带5和7仅存在于SCS03样品中。由此可见,不同酸菜样品间乳酸杆菌的多样性亦存在一定的差异。本研究进一步对各条带进行了序列分析,结果如表2-8所示。

图2-13 酸菜水中乳酸杆菌PCR-DGGE电泳图
注:01、02和03分别为SCS01、SCS02和SCS03。
表2-8 酸菜水中乳杆菌DGGE条带比对结果
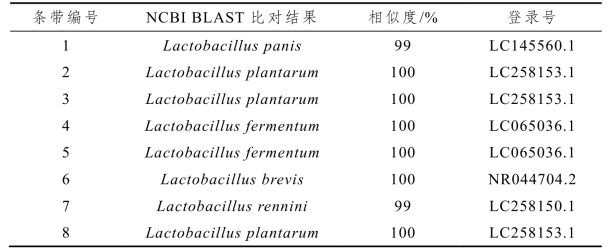
由表2-8可知,8个特异性条带均属于乳酸杆菌属,且各条带序列与现有数据库中已知16s rDNA序列都具有较高的相似度。其中条带2、3和8为植物乳杆菌(Lactobacillus plantarum),条带4和5为发酵乳杆菌(Lactobacillus fermentum),条带1为面包乳杆菌(Lactobacillus panis),条带6为短乳杆菌(Lactobacillus brevis),条带7为Lactobacillus rennini(暂无中文翻译)。本研究进一步将鉴定结果与数据库中的模式菌进行了系统发育树的构建,结果如图2-14所示。
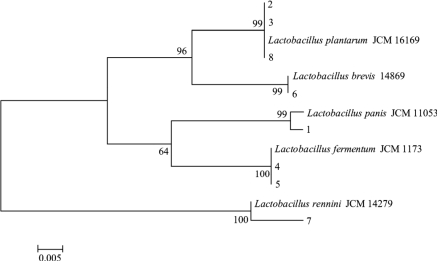
图2-14 系统发育树
由图2-14可知,系统发育树分为两大支,条带1、2、3、4、5、6和8均在同一分支上,这表明上述菌株的亲缘关系较近,而条带7在另一分支上,这可能是由于该菌株的进化关系较之其他菌株较远导致的。武瑞俊利用PCR-DGGE技术对东北自然发酵酸菜中乳酸菌的多样性进行了分析,在5份酸菜中共鉴定出9株乳酸菌,其中优势乳酸菌是植物乳杆菌(Lactobacillus plantarum)和短乳杆菌(Lactobacillus brevis)[23]。而周金明利用PCR-DGGE技术对不同发酵时期酸菜发酵液微生物菌群进行了研究,结果发现植物乳杆菌(Lactobacillus plantarum)和清酒乳杆菌(Lactobacillus sakei)是酸菜发酵过程中的优势菌[24],其研究的结果与本研究相同。
4.酸菜水中乳酸菌分离鉴定结果
本研究进一步使用含有1.5% CaCO3的MRS培养基对3个酸菜水样品进行了乳酸菌的分离鉴定,测序比对结果如表2-9所示。
表2-9 酸菜水中16s rDNA基因序列比对结果
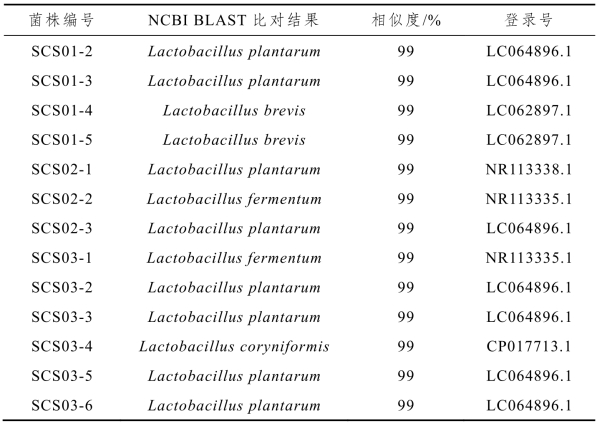
由表2-9可知,从3个样品中共分离出8株植物乳杆菌(Lactobacillus plantarum)、2株短乳杆菌(Lactobacillus brevis),2株发酵乳杆菌(Lactobacillus fermentum)和1株棒状乳杆菌(Lactobacillus coryniformis),这进一步证实恩施地区酸菜水中的乳酸菌具有较高的多样性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




