分子和原子一样,具有特征分子能级。分子内部的运动可分为价电子运动、分子内原子在平衡位置附近的振动和分子绕其重心的转动。因此,分子具有电子(价电子)能级、振动能级和转动能级。双原子分子的电子、振动、转动能级如图5-1所示。实际上电子能级间隔比图示大得多,而转动能级间隔比图示小得多。分子的能量E等于电子能Ee、振动能Ev和转动能Er之和。
![]()
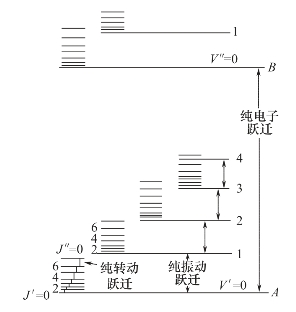
图5-1 双原子分子的三种能级跃迁图
分子从外界吸收能量后,就能引起分子能级的跃迁,即从基态跃迁到激发态能级。分子吸收能量具有量子化特征,即分子只能吸收等于两个能级之差的能量。电子能级跃迁所需的能量较大,一般为1~20eV。电子能级跃迁时不可避免地要产生振动和转动能级的跃迁。振动能级的能量差一般为0.025~1eV,转动能级的间隔一般小于0.025eV。
因此,当电子跃迁的能级差为5eV时,所需吸收的光波的波长为:
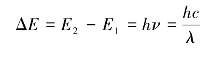
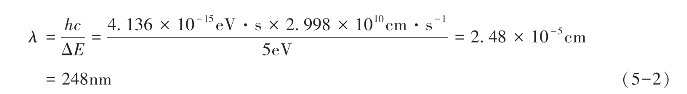
此时,由于电子能级跃迁而产生的吸收光谱主要处于紫外—可见光区(200~800nm)。这种分子光谱称为电子光谱或紫外—可见光谱。(https://www.xing528.com)
此时,假设振动的能级差为0.1eV,则它为5eV电子能级间隔的2%,其波长间隔为248nm×2%≈5nm。假设转动的能级差为0.005eV,则它为5eV电子能级间隔的0.1%,其波长间隔为248nm×0.1%=0.25nm。可见,分子光谱远较原子光谱复杂,产生的是一系列线,一般包含有若干谱带系。不同谱带系相当于不同的电子能级跃迁,一个谱带系含有若干谱带,不同谱带相当于不同的振动能级跃迁。同一谱带内又包含若干光谱线,每一条线相当于转动能级的跃迁。一般分光光度计的分辨率,观察到的为已合并的较宽谱带,因此分子光谱为带状光谱。
不同波长范围的电磁波所能激发的分子和原子的运动情况见表5-1,电磁波谱图如图5-2所示。
表5-1 电磁波谱
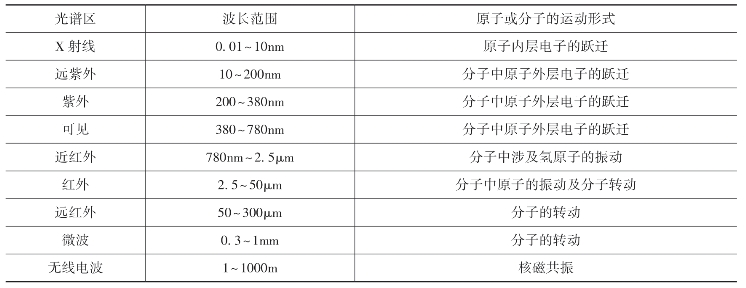
注 波长范围的划分并不是很严格,在不同的文献资料中会有所出入。
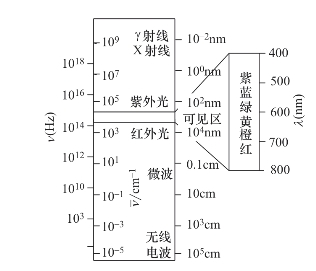
图5-2 电磁波谱图
紫外光谱的英文描述如下:
When electromagnetic radiations from the ultraviolet part of the spectrum impinge on a molecule,its valence electrons are set in vibration and produce an excitation from the ground electronic state of the molecule to an excited electronic state.The range lying between 200 and 400 nm (1 nanometer=10-9 meter=10-7 cm=10 Å=1mμ) is known as near or common ultraviolet.As most of the unsaturated organic compounds absorb at these wavelengths,this region is of special interest to an organic chemist.Saturated compounds absorb below 200 nm (far UV) as they require higher energy for excitation of a strongly bonded sigma (σ) electron.This much high energy is generally no attainable with the available spectrophotometers.The region extending from 400 to 800 nm is called visible range.All colored compounds absorb in this region.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




