由于分子由原子组成,原子又由原子核及核外电子组成,因此,在任何一个分子中,都可以找到一个正电荷中心和一个负电荷中心。通常将正、负电荷中心重合的分子称为非极性分子,正、负电荷中心不重合的分子称为极性分子。
对于简单的双原子分子,分子是否有极性可以简单地用共价键的极性来判断。由非极性键构成的分子是非极性分子,如单质H2、O2、F2等分子;由极性键构成的分子是极性分子,如HCl、CO等。
对于多原子分子,分子的极性不仅与共价键的极性有关,还与分子的空间构型有关。如同样为AX3型的NF3和BF3分子,其分子中的共价键虽然都是极性共价键,但由于BF3分子具有对称的平面正三角形结构,键的极性互相抵消,因此,整个分子是非极性的;而NF3分子的空间构型为三角锥体,键的极性不能相互抵消,所以整个分子具有极性。因此,在由极性键构成的多原子分子中,分子的空间构型如有对称中心,则分子就是非极性分子,如CO2、BF3、CH4等分子;而当分子中没有对称中心时,则分子就是极性分子,如NH3、SO2等。
分子的极性常用分子偶极矩(dipole moment)来衡量。分子偶极矩μ等于正电荷中心(或负电荷中心)的电荷量q与正、负电荷中心之间的距离d的乘积:
![]()
偶极矩的方向规定为从正电荷指向负电荷。d是分子中正、负电荷中心之间的间距,又称为偶极长,偶极距的单位为C·m(库仑·米)。对于双原子分子,分子的偶极矩等于其共价键的偶极矩;而对于多原子分子,分子的偶极矩等于分子中各共价键偶极矩的向量和,而不是等于某一共价键的偶极矩。(https://www.xing528.com)
分子的偶极矩越大,分子的极性越强;分子的偶极矩越小,分子的极性越弱;若分子的偶极矩μ=0,则为非极性分子。
对于正、负电荷中心不重合的极性分子来说,分子中始终存在着一个正极和一个负极,这种极性分子本身具有的偶极称为固有偶极或永久偶极。值得注意的是,分子的极性并不是一成不变的,在外电场的作用下,非极性分子和极性分子中的正、负电荷中心会发生相对的变化。
在电场的作用下,非极性分子中的正、负电荷中心发生相对位移,变成具有一定偶极的极性分子。而极性分子在外电场的作用下其偶极也会增大。
这种在外电场作用下产生的偶极称为诱导偶极(induced dipole)。任何一个分子,由于原子核和电子都在不停地运动,不断地改变其相对位置,致使分子的正、负电荷中心在瞬间不相重合,这时产生的偶极称为瞬时偶极。一般来说,分子越大,越容易变形,产生的瞬时偶极越大。如图3-38所示。
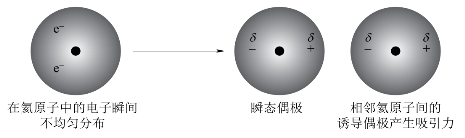
图3-38 瞬态偶极和诱导偶极
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




