由式(4.4)所表示的酸碱平衡中的氢离子实际上大都不能单独存在,因为质子的离子半径小,又带正电荷,所以不可能以游离状态存在。事实上,质子在水溶液中的平均寿命约10-14 s。因此,质子一出现,便立即附着于另一分子或离子(通常是溶剂分子),产生一种酸。例如:

这又是一个共轭酸碱对,其中H2O是质子论中的碱。
显然,在溶液中,式(4.4)中各反应必然存在另一种共轭酸碱对:


由式(4.5)可见,通过两个共轭酸碱对的反应,净的结果是HAc把质子H+传递给了H2O。如果没有共轭酸碱对2(即第二个反应)的存在,没有H2O接受H+,则HAc就不能发生在水中的解离。
式(4.5)表明,任何酸碱反应都可以看作是质子在两个酸碱对之间的传递。由于式(4.4)中的反应不能单独进行,故称为酸碱半反应(half-reaction of acid-base)(这与氧化还原半反应类似)。质子传递反应(protolysis reaction)是两个酸碱半反应的结合。质子传递的方向则与酸碱的强度有关,若酸1是强酸,碱2是强碱,则质子传递反应(即式(4.5)的反应)向右进行。若碱1是弱碱,酸2是弱酸,则质子传递反应也能向右进行。而生成强酸和强碱的反应是很难进行的,因此,质子传递反应一般总是朝着生成比原先更弱的酸和碱的方向进行。
一种化合物是否表现为酸,在很大程度上与溶剂的性质有关。例如,氯化氢溶于苯,但不显示酸性,这是因为苯分子的碱性很弱,而且介电常数很低(ε=2.27 F·m-1)。在像水这样的溶剂中,因水具有显著的碱性且介电常数较高,氯化氢发生完全解离。
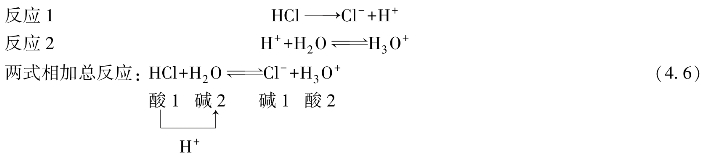
H3O+代表碱H2O的共轭酸,称为水合氢离子。按照质子论,醋酸根离子可接受一个质子,所以是一种碱,在水溶液中可发生下列酸碱反应:

式(4.7)中,H2 O是酸,氢氧根离子OH-是酸H2 O的共轭碱。由式(4.6)和式(4.7)可见。水分子是一种两性物质,它既可给出质子起酸的作用,又可接受质子起碱的作用。于是在水分子间也可发生质子交换。水的这种酸碱反应称为水的质子自递反应:
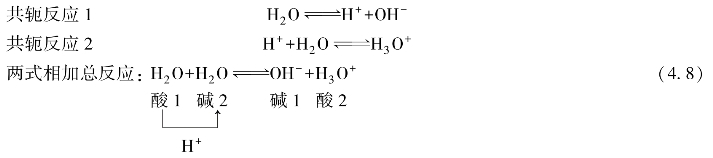
式(4.8)的平衡常数表达式为:

由于纯液体的浓度视为1,因此,式(4.9)可写成:(https://www.xing528.com)

K w称为水的质子自递常数,其数值与温度有关。例如,在0℃时为1.10×10-15,25℃时为1.00×10-14,100℃时为5.50×10-13。在25℃的纯水中:

可见,通常所说纯水的pH为7是针对25℃时的水而言。
质子理论最明显的优点是将阿仑尼乌斯的水-离子理论推广到所有能发生质子传递的系统,而不管它的物理状态如何,也不管是否有溶剂。例如,下列反应都是质子理论范畴中的酸碱反应:
①在溶液NH3中:
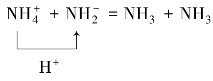
②HCl(g)和NH3(g)反应,生成NH4Cl固体:

③某种固液相反应:

从原则上讲,任何含有氢的化合物,都可能成为酸,但实际上很多含氢化合物(如烃类CH4等)失去质子的趋势极小,所以通常不把它们看作酸。同样,任何酸的阴离子都是碱,但对于非常强的酸的阴离子,如Cl-,接受质子的趋势很小,所以通常不把它们看作碱。
许多反应如酸(碱)的电离、弱酸(弱碱)根的水解、中和反应、盐的生成反应等都可以纳入以质子的传递为基础的酸碱质子理论,见表4-3。
表4-3 酸碱质子理论实例
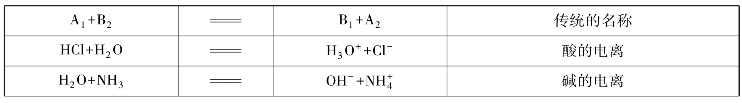
续表

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




