合金组元间相互作用,除了可形成固溶体外,当超过固溶体的固溶度极限时,还可形成金属化合物,又称为中间相。金属化合物的晶体结构及性能均不同于任一组元,一般可以用分子式来大致表示其组成。金属化合物的原子间结合方式取决于元素的电负性差值,结合键主要为金属键,但也可能同时存在离子键、共价键等,因此它具有一定的金属性质,称为金属化合物。金属化合物的种类有很多,下面主要介绍以下三种类型。
1.正常价化合物
正常价化合物是指金属与电负性较强的元素形成的符合化合价规律的金属化合物,通常由金属元素与元素周期表中的IVA、VA、VIA族元素组成,如MgS、MnS、Mg2Si、Mg2Sn、Mg2Pb等。其中,MnS是钢铁材料中常见的夹杂物,Mg2Si则是铝合金中常见的强化相。
正常价化合物由电负性相差较大的元素形成,根据电负性差值的大小,原子间结合键的类型分别以离子键、共价键或金属键为主。正常价化合物具有严格的化合比,成分固定不变,可用化学式表示。这类化合物一般具有较高的硬度,脆性较大。
2.电子化合物
电子化合物是由IB族或过渡族金属元素与IIB、ⅢA、IVA族金属元素形成的金属化合物,它们是不遵守原子价规律,而是按照一定电子浓度的比值形成的化合物,电子浓度不同,所形成的化合物的晶体结构也不同。例如,电子浓度为3/2(21/14)时,具有体心立方结构,称为β相;电子浓度为21/13时,为复杂立方结构,称为γ相;电子浓度为7/4(21/12)时,则为密排六方结构,称为ε相。一些常见的电子化合物及其结构类型见表1-4。
电子化合物虽然可用化学分子式表示,但不符合化合价规律,而且其成分可在一定范围内变化,可视其为以化合物为基的二次固溶体。电子化合物原子间的结合键以金属键为主,通常具有很高的熔点和硬度,但脆性很大。
表1-4 常见电子化合物及其结构类型

3.原子尺寸因素化合物
原子尺寸因素化合物的晶体结构主要取决于原子尺寸因素。当两组元间原子半径相差很大时,倾向于形成间隙相和间隙化合物。例如,原子半径较小的非金属元素,如H、N、C、B等可与金属元素(主要是过渡族金属)形成间隙相或间隙化合物,这主要取决于非金属原子半径(rX)和金属原子半径(rMe)的比值。当rX/rMe<0.59时,形成具有简单晶体结构的间隙相;当rX/rMe>0.59时,则形成具有复杂晶体结构的间隙化合物。由于氢和氮的原子半径仅为0.046nm和0.071nm,尺寸很小,故它们与所有过渡族金属均满足rX/rMe<0.59的条件。因此,过渡族金属的氢化物和氮化物都为间隙相;而硼的原子半径为0.097nm,尺寸较大,则过渡族金属的硼化物均为间隙化合物;碳原子处于中间状态,某些碳化物如TiC、VC、NbC、WC等是结构简单的间隙相,而Fe3C、Cr7C3、Cr23C6、Fe3W3C等则是结构复杂的间隙化合物。(https://www.xing528.com)
(1)间隙相 间隙相都具有简单的晶体结构,如面心立方、体心立方、密排六方或简单六方等,金属原子位于晶格的正常结点上,非金属原子则位于晶格的间隙位置。间隙相的化学成分可以用简单的分子式表示,如M4X、M2X、MX、MX2,但是它们的成分可以在一定的范围内变动。这是由于间隙相晶格中的间隙未被填满,即某些本应为非金属原子占据的位置出现了空位,相当于以间隙相为基的固溶体。
间隙相不但可以溶解组元元素,而且可以溶解其他间隙相,有些具有相同结构的间隙相甚至可以形成无限固溶体,如TiC-ZrC、TiC-VC、TiC-NbC、TiC-TaC、ZrC-NbC、ZrC-TaC、VC-NbC、VC-TaC等。
应当指出,间隙相与间隙固溶体之间有着本质的区别,间隙相是一种化合物,它具有与其组元完全不同的晶体结构,而间隙固溶体则仍保持着溶剂组元的晶格类型。钢中常见的间隙相见表1-5。
表1-5 钢中常见的间隙相
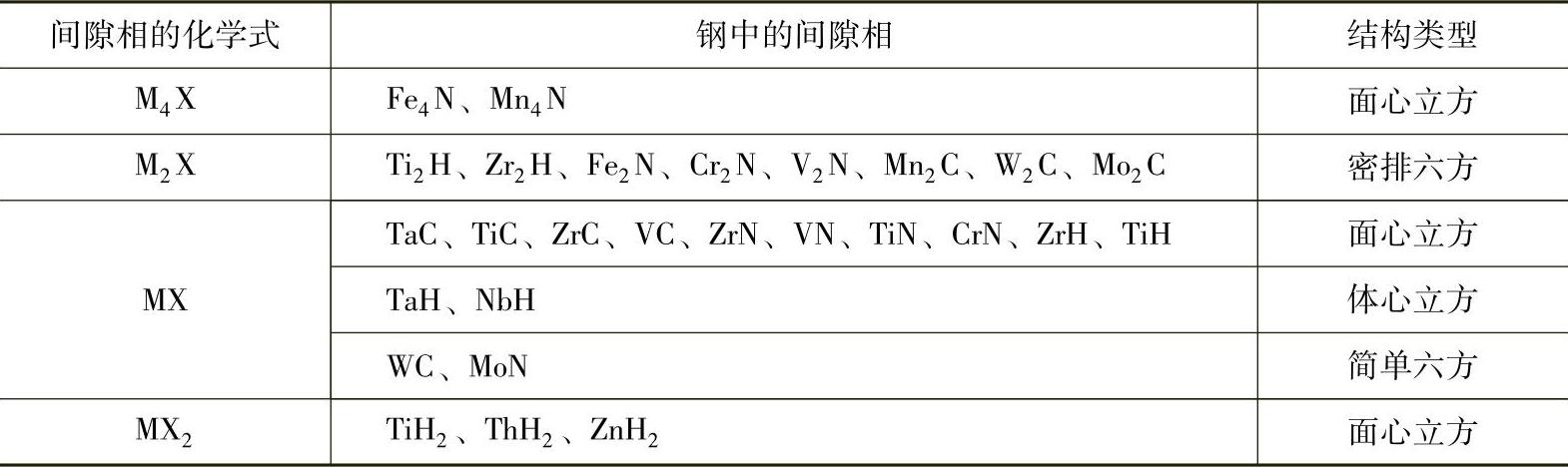
间隙相具有极高的熔点和硬度(表1-6),具有明显的金属特性,如具有金属光泽和良好的导电性等。它们是硬质合金的重要组成相,还是合金工具钢和高温金属陶瓷的重要组成相。
(2)间隙化合物 间隙化合物一般具有复杂的晶体结构,Cr、Mn、Fe的碳化物均属于此类。它的种类很多,合金钢中经常遇到的有M3C(如Fe3C、Mn3C)、M7C3(如Cr7C3)、M23C6(如Cr23C6)和M6C(如Fe3W3C、Fe4W2C)等。其中的Fe3C是钢铁材料中的一种基本组成相,称为渗碳体。Fe3C中的铁原子可以被其他金属原子(如Mn、Cr、Mo、W等)所置换,形成以间隙化合物为基的固溶体,如(Fe,Mn)3C、(Fe,Cr)3C等,称为合金渗碳体。其他间隙化合物中的金属原子也可被其他金属元素置换。
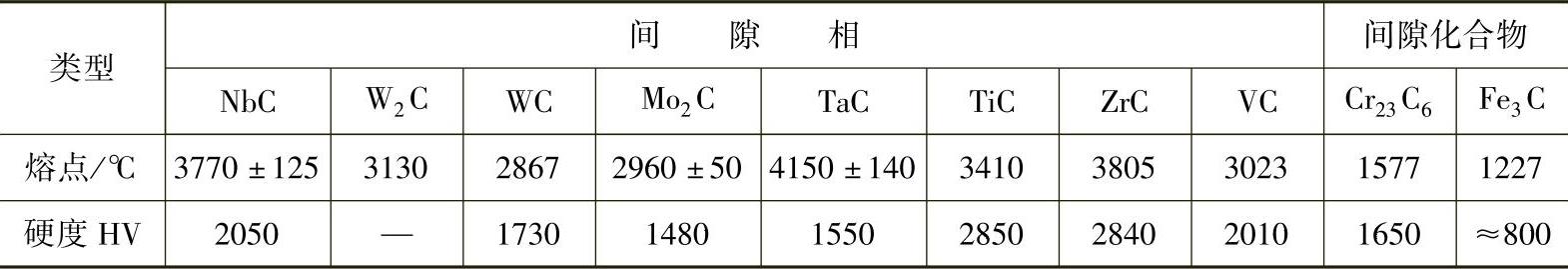
间隙化合物也具有很高的熔点和硬度,但与间隙相相比,它们的熔点和硬度要低些,而且加热时也较易分解。这类化合物是碳钢及合金钢中的重要组成相。钢中常见碳化物的硬度及熔点见表1-6。
表1-6 钢中常见碳化物的熔点及硬度
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




