碳在元素周期表中位于非金属性最强的卤族元素和金属性最强的碱金属元素之间。它的价电子构型为2s22p2,在化学反应中既不容易失去电子,也不容易得到电子,难以形成离子键,而是形成特有的共价键,最高共价数为4。碳原子以sp3杂化,可以生成4个σ键,形成正四面体构型,如金刚石、CH4、CCl4等;碳原子以sp2杂化,生成3个σ键、1个π键,形成平面三角形构型,如C2H4、石墨、苯等;碳原子以sp杂化,生成2个σ键、2个π键,形成直线形构型,如CO2、C2H2、HCN等;碳原子以sp杂化,生成1个σ键、1个π键、1个配位π键和1对孤电子对,形成直线形构型,如CO。
1.碳单质
碳有多种同素异形体(金刚石、石墨和C60等)和无定形体(活性炭)。金刚石是典型的原子晶体,在金刚石中,每个碳原子都以sp3杂化轨道与邻近的4个碳原子以σ键相连接,形成三维网络骨架结构,如图8-33(a)所示。这种结构使金刚石具有硬度大、熔沸点高、化学性质不活泼的性质。在所有物质中,金刚石的硬度最大。金刚石是熔点最高的单质,其熔点高达3 550℃。由于金刚石晶体的每个碳原子都采取sp3杂化,所有价电子都参与了共价键的形成,晶体中没有自由电子,所以金刚石不导电。透明的金刚石可以作宝石或钻石,价格极其高昂。除作装饰品外,黑色和不透明的金刚石在工业上用于制造钻头、精密仪器的轴和切割金属、玻璃矿石的工具。金刚石粉是优良的研磨材料,可以制砂轮。
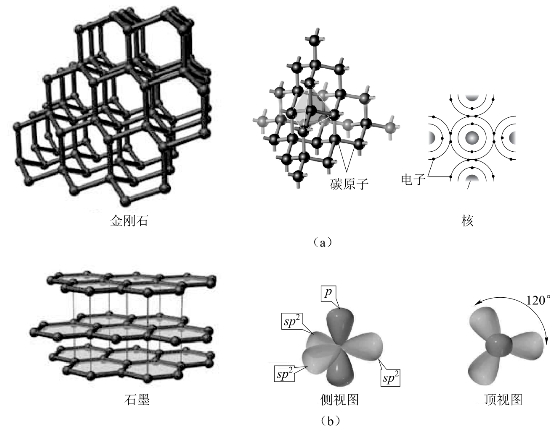
图8-33 金刚石(a)和石墨(b)的结构
石墨是原子晶体、金属晶体和分子晶体之间的一种过渡型晶体,是碳的另一种固体单质,是较软的黑色固体,略有金属光泽。其熔点略低于金刚石。石墨晶体中每个碳原子以sp2杂化轨道和邻近的3个碳原子以共价单键相连接,构成片层结构,如图8-33(b)所示,每个碳原子均有一个未参与杂化的p电子,形成一个离域的大π键。这些离域电子可以在整个碳原子平面层中自由移动,所以石墨具有层向的良好导电导热性质。石墨的层与层之间是以分子间力结合起来的,由于层间的分子间力很弱,所以层间易于滑动,因此,石墨质软,具有润滑性。
由于石墨导电导热,具有化学惰性,耐高温,易于成型和机械加工,所以被大量用于制作电极、高温热电偶、坩埚、电刷、润滑剂和铅笔芯等。
20世纪80年代中期,人们发现了碳元素还存在第三种晶体形态。其分子式C n中n一般小于200,称为碳原子簇。在种类繁多的碳原子簇中,人们对C60研究得最为深入。C60分子中的60个碳原子构成近似于球形的三十二面体,即由12个正五边形和20个正六边形组成,相当于截角正二十面体。每个碳原子以sp2杂化轨道和相邻三个碳原子相连,未参加杂化的p轨道在C60的球面形成大π键。由于其形状酷似足球,因此称为足球烯,又称富勒烯。其结构如图8-34所示。将C60称为足球烯、富勒烯,是因为C60中有双键,但是必须强调的是,C60是碳的一种单质,而不是化合物,不是烯烃。

图8-34 富勒烯球的结构
科学家认为C60将是21世纪的重要材料。C60分子具有球形的芳香性,可以合成C60 F n,作为超级润滑剂。C60笼内可以填入金属原子而形成超原子分子,作为新型催化剂或催化剂载体,具有超导性。掺K的C60固体超导转变温度T c=18 K,Rb3C60的T c=29 K,它们是三维超导体。C60晶体有金属光泽,其微晶体粉末呈黄色,易溶于苯,苯溶液呈紫红色。C60分子很稳定,进行化学反应时,始终是一整体。
碳单质最重要的化学性质是它的还原性。碳在空气中燃烧,生成二氧化碳。
![]()
焦炭是冶金工业的重要还原剂,被用来还原金属氧化物矿物以冶炼金属。例如,提取金属锌,其中的一步反应是在1 200 K温度下进行的。
![]()
2.碳的化合物
碳的化合物主要有氧化数为-4的化合物,如CH4、Al4C3、MC、M2C等;氧化数为+2的化合物,如CO;氧化数为+4的化合物,如CO2、碳酸及碳酸盐、COCl2(氯化碳酰又称光气,是极毒的)、CS2、CX4等。这里主要介绍CO、CO2、碳酸及碳酸盐、CS2和CCl4。
(1)一氧化碳
在CO分子中,碳原子采取sp杂化与氧原子成键。C原子的2个p电子可以与O原子的2个成单的p电子形成一个σ键和一个π键,O原子上的成对的p电子还可以与C原子上的一个空的2p轨道形成一个配位键。如图8-35所示。

图8-35 一氧化碳的成键特性及HOMO、LOMO分子及轨道
CO是碳在氧气不充足的条件下燃烧的产物。工业上CO气体的大量生产,是将空气和水蒸气交替通入红热炭层。通入空气时的反应为:
![]()
放出大量的热,得到的气体的组成为
![]()
这种混合气体称为发生炉煤气。通入水蒸气时的反应为:
![]()
这是一个吸热反应,得到的气体的组成为CO∶CO2∶H2=40∶5∶50(体积比),这种混合气体称为水煤气。炉煤气和水煤气都是CO气体的主要来源,都是工业上的燃料气。
CO是一种无色、无臭的气体。在CO分子中,因C原子略带负电荷(分子内π配键所致),这个C原子比较容易向其他有空轨道的原子提供电子对形成配位键并生成许多羰基化合物。这也是CO分子的键能(1 072 kJ/mol)比N2分子的大(942 kJ·mol-1),而它却比N2活泼的一个原因。
CO属于还原性气体。它是冶金过程中的还原剂,可以将金属氧化物矿物还原成金属。CO气体可以还原溶液中的二氯化钯,使溶液变黑。
![]()
该反应十分灵敏,可用来检验CO。
CO与CuCl的酸性溶液的反应进行得很完全,可以用来定量吸收CO。
![]()
在高温下,CO作为一种配体,能与许多过渡金属反应生成金属羰基配合物,例如:
![]()
羰基配合物一般是剧毒的。CO对人体的毒性也很大,原因是CO能与血红素(Hb)中的铁结合成羰基配合物,从而使血液失去输送氧的作用。

CO对HbFe(Ⅱ)配位能力为O2的230~270倍,当空气中的CO的体积分数达到0.1%时,将会引起中毒。当血液中50%的血红蛋白与CO结合时,即可引起心肌坏死。
(2)二氧化碳
CO2与人类的关系十分密切,它是人体内氧化还原反应的最终产物之一。实际上,只要氧气充足,碳的燃烧都将生成CO2。常温常压下CO2是无色气体,在降温或减压下,CO2较容易变成液体或固体。高压钢瓶中的CO2是以液态存在的,从钢瓶中取出CO2使用时,液态CO2迅速汽化,致使温度骤降,将生成固态CO2(干冰)。干冰可以升华,因此常用来作制冷剂。(https://www.xing528.com)
工业上煅烧石灰石生产生石灰的过程中,有大量的CO2生成。
![]()
实验室中用碳酸盐和盐酸的作用来制备CO2。
![]()
CO2分子是直线形的,一般认为C、O之间有双键:一个σ键和一个π键。它解释了CO2分子的非极性及CO2具有很高的热稳定性的原因。
但是结构数据表明,CO2中碳氧键长介于碳氧双键=C O和碳氧三键 ≡C O的键长之间。这一事实要用CO2分子中存在大π键来解释。中心碳原子采取sp杂化方式,用sp杂化轨道与氧原子的2p轨道成σ键,形成直线形CO2分子。在y方向,左边氧原子的2py轨道有1个电子,右边氧原子的2py轨道有2个电子,中心碳原子的2py轨道有1个电子。于是在y方向形成一个离域的![]() 大π键。同样,在z方向也形成一个
大π键。同样,在z方向也形成一个![]() 大π键,如图8-36所示。
大π键,如图8-36所示。
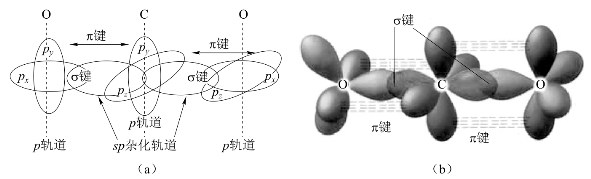
图8-36 二氧化碳成键方式
CO2是工业上生产小苏打NaHCO3和碳酸氢铵NH4HCO3等的重要原料。
(3)碳酸和碳酸盐
二氧化碳溶于水生成碳酸。碳酸H2CO3是二元弱酸,其解离平衡常数如下:

碳酸的盐类有两种:碳酸盐(正盐)和碳酸氢盐。NaHCO3俗称小苏打,溶液显碱性。Na2CO3俗称纯碱,溶液显碱性。图8-37所示为碳酸和碳酸氢根的结构。

图8-37 碳酸和碳酸氢根
(a)碳酸;(b)碳酸氢根
下面重点介绍这两类盐在水中的溶解性、水解性和热稳定性。
碱金属(Li除外)、铵![]() 和铊(Tl+)的碳酸盐易溶于水。其他金属的碳酸盐难溶于水。例如,(NH4)2CO3、Na2CO3等易溶于水,CaCO3、MgCO3等难溶于水。对于难溶的碳酸盐,其相应的碳酸氢盐却有较大的溶解度。难溶的碳酸钙矿石在CO2和水的长期侵蚀下,可部分地转变为Ca(HCO3)2而溶解。
和铊(Tl+)的碳酸盐易溶于水。其他金属的碳酸盐难溶于水。例如,(NH4)2CO3、Na2CO3等易溶于水,CaCO3、MgCO3等难溶于水。对于难溶的碳酸盐,其相应的碳酸氢盐却有较大的溶解度。难溶的碳酸钙矿石在CO2和水的长期侵蚀下,可部分地转变为Ca(HCO3)2而溶解。
![]()
对于易溶的碳酸盐,其相应的碳酸氢盐却有相对较低的溶解度。向浓的碳酸氨溶液通入CO2至饱和,便可沉淀出NH4HCO3,这是工业上生产碳铵肥料的基础。
碱金属和铵的碳酸盐和碳酸氢盐在水溶液中均因水解而分别显强碱性和弱碱性。

在金属盐类(碱金属和铵盐除外)溶液中加入![]() 时,产物可能是碳酸盐、碱式碳酸盐或氢氧化物。究竟是哪种产物,一般取决于反应物的性质(金属离子的水解性)和生成物的性质(金属碳酸盐、氢氧化物的溶解)。
时,产物可能是碳酸盐、碱式碳酸盐或氢氧化物。究竟是哪种产物,一般取决于反应物的性质(金属离子的水解性)和生成物的性质(金属碳酸盐、氢氧化物的溶解)。
金属离子不水解,如Ba2+、Ca2+、Ag+等,其碳酸盐的溶解度又很小,则可沉淀为碳酸盐。例如:
![]()
金属离子有一定程度的水解,如Cu2+、Zn2+、Pb2+等,其氢氧化物和碳酸盐的溶解度相差不多,则可沉淀为碱式碳酸盐。例如:
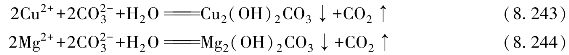
金属离子具有强水解性,特别是两性的金属离子,如Al3+、Cr3+、Fe3+等,其氢氧化物的溶解度很小,则可沉淀为氢氧化物。例如:

因此碳酸钠、碳酸铵常用作金属离子的沉淀剂。
热不稳定性是碳酸盐的一个重要性质,一般有下列热稳定性顺序:碱金属的碳酸盐>碱土金属碳酸盐>d区、ds区和p区重金属的碳酸盐。碳酸盐受热分解的难易程度与阳离子的极化作用有关。阳离子的极化作用越大,碳酸盐就越不稳定。例如:
![]()
H+(质子)的极化作用最强,所以热稳定性:碳酸盐>碳酸氢盐>碳酸。
(4)碳的硫化物和卤化物
二硫化碳(CS2)是易挥发(沸点为226.9 K)、有毒的无色液体,极易燃。
![]()
和CO2相似,CS2也是直线形分子![]() ,其偶极矩为零,是常用的有机溶剂。CS2不溶于水,但在高于150℃时,CS2与水反应。
,其偶极矩为零,是常用的有机溶剂。CS2不溶于水,但在高于150℃时,CS2与水反应。
![]()
CS2可作有机物、磷和硫的溶剂,大量地被用于生产黏胶纤维,其次用于制玻璃纸和CCl4。农业上还用它控制虫害。在碳的卤化物中最常见的为四氯化碳。CCl4是非极性分子,稳定,不分解,密度比水的大。CCl4可以与乙醇及其他有机溶液完全互溶,是实验室常用的不燃溶剂。工业上和实验室中常用它溶解油脂和树脂。CCl4是常用的灭火剂,但不能扑灭燃着的金属钠。图8-38所示为四氯化碳和二硫化碳的结构。

图8-38 四氯化碳(a)和二硫化碳(b)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




