自然界的磷主要以磷灰石Ca5(PO4)3(F、Cl、OH)、磷钙石Ca3(PO4)2存在。在生物体内也有大量的磷,骨头中Ca5(PO4)3(OH)形成矿物质部分,牙齿中含有Ca5(PO4)3F,大脑和神经细胞中含有复杂的有机磷的衍生物,可见磷是重要的生命元素之一。
磷的性质与氮的有很大的差别,主要是由于磷原子的价电子层结构是3s23p3,第三电子层有5个价电子,还有5个空的3d轨道,可以形成离子键、共价键和配位键。
1.磷单质
磷有多种同素异形体,其中常见的是白磷(又称黄磷)、红磷和黑磷。通常所说的磷单质指的就是白磷。纯白磷是无色透明的晶体,遇光逐渐变为黄色,所以又称黄磷。白磷可溶于苯和二硫化碳中,白磷有剧毒,误食0.1 g就能致死。白磷晶体是由分子组成的分子晶体,P4分子是四面体构型,如图8-24所示。分子中P—P键长是221 pm,键角∠PPP=60°,所以P4分子具有张力,这种张力的存在使每一个P—P键的键能减弱,仅201 kJ·mol-1,易于断裂,因此,白磷在常温下有很高的化学活性。

图8-24 P4分子构型(a)及白磷(b)、红磷(c)和紫磷(d)
白磷与空气接触时发生缓慢氧化作用,部分反应能量以光能的形式放出,这种现象称为磷光现象。白磷的燃点为34℃,可自燃,因此,通常将白磷储存于水中以隔绝空气。白磷的还原性强,与氧化剂反应剧烈,同卤素单质激烈地反应,在氯气中也能自燃生成PCl3或PCl5。白磷在空气中燃烧时呈黄色火焰,生成P4O6或P4O10。与冷浓硝酸反应激烈生成磷酸。
![]()
白磷在热的浓碱溶液中发生歧化反应生成磷化氢和次磷酸盐。
![]()
白磷在H2O中的歧化速率相当小,可以忽略,因此,少量的白磷可以放在H2O中保存。
2.磷的化合物
磷的化合物主要有氢化物、卤化物、氧化物、含氧酸及其盐。
(1)磷的氢化物
磷和氢可组成一系列氢化物,如PH3、P2H4、P12 H16等,其中重要的是PH3,称为膦。膦是一种无色、大蒜气味的剧毒气体。与NH3相似,PH3具有三角锥形的结构,但其键角要小得多,仅为93.6°。PH3分子的偶极矩μ=0.58D,极性比NH3的弱得多,在水中的溶解度比NH3的小得多。膦的碱性比NH3的弱得多,其碱式解离常数约为10-28。PH3中P的氧化数为-3,它是一个强还原剂。

在150℃下,PH3能与氧气燃烧生成H3PO4。
![]()
平时制得的磷化氢在空气中能自燃,是因为在这个气体中常含有更活泼、易自燃的联膦P2H4,它与联氨是类似物,也是强还原剂。膦能从某些金属盐(Cu2+、Ag+、Hg2+)溶液中将金属置换出来。
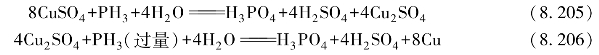
PH3的配位能力比NH3的强,这是由于配合物中的中心离子可以向PH3配体中的磷原子的3d空轨道反馈电子,形成反馈π键。
(2)磷的卤化物
卤化磷主要有三卤化磷PX3和五卤化磷PX5两种类型,常见的是磷的氯化物。如图8-25所示。

图8-25 三氯化磷和五氯化磷
(a)三氯化磷;(b)五氯化磷
PF3(无色气体),PCl3(无色液体),PBr3(无色液体),PI3(红色固体)
PF5(无色气体),PCl5(白色固体),PBr5(黄色固体),PI5(不易生成)
在一定条件下,氯、溴单质可直接与白磷反应得到相应的三氯化磷和三溴化磷。过量的卤素单质与磷反应可得到五卤化磷。在三卤化磷分子中,磷原子采取sp3杂化,分子呈三角锥形,磷原子上还有一对孤电子对。在五卤化磷分子中,磷原子采取sp3d杂化,在蒸气状态下,分子呈三角双锥形,磷原子位于锥体的中央。
卤化磷的最重要的性质是其水解性,五氯化磷完全水解生成磷酸,控制条件可部分水解为三氯氧磷(氯化磷酰或氯氧化磷)。三氯氧磷在制药生产中经常用于合成磷酸酯或作为卤化剂。

在固态时,PCl5形成离子晶体,在其晶格中含有正四面体的[PCl4]+和正八面体的[PCl6]-,两者以离子键相结合。
(3)磷的氧化物
磷的氧化物主要有三氧化二磷P4O6和五氧化二磷P4O10两种。磷在不充分的空气中燃烧生成的氧化物为P4O6。P4O6可以看作以P4为基础形成的,P4分子中的P—P键因有张力而不稳定,氧分子进攻时断裂,在每两个P原子间嵌入一个氧原子,于是形成了P4O6分子,如图8-26所示。形成P4O6分子后,4个P原子的相对位置并不发生变化,分子中的氧原子全部为桥氧,分子具有类似球状的结构而容易滑动,因此P4O6分子有滑腻感。在P4O6分子中,每个磷原子上还有一个孤电子对,向氧原子空的p轨道配位,形成d-pπ配键;同时,氧原子p轨道中的电子对向磷原子空的d轨道配位,形成d-pπ配键,即每个磷上又增加一个端氧,形成P4O10。分子中有6个桥氧和4个端氧,端氧与磷之间的化学键可以看成双键,如图8-26所示。
P4O6是有滑腻感的白色吸潮性蜡状固体,有毒,易溶于有机溶剂中,溶于冷水时缓慢反应生成亚磷酸(H3PO3)。和热水反应时,发生歧化反应生成膦和磷酸。


图8-26 P4O6和P4O10的结构与生成反应
P4O10是白色粉末状固体,是磷酸酐。P4O10同水作用时放出大量的热,生成P(Ⅴ)的各种含氧酸。水量不足时,生成偏磷酸,水略多于上述情况时,将生成焦磷酸。

当有足量的水、加热并有硝酸催化时,P4O10将很快地完全转化为磷酸。
![]() (https://www.xing528.com)
(https://www.xing528.com)
P4O10有很强的吸水性,在空气中很快就潮解,是最强的干燥剂之一。P4O10还可以从许多化合物中夺取化合态的水,是强脱水剂。
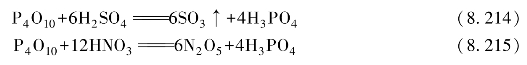
(4)磷的含氧酸及其盐
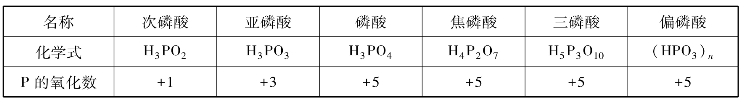
磷有多种氧化数的含氧酸,其中较重要的见表8-10。
表8-10 磷的含氧酸
纯的次磷酸(H3PO2)为白色固体,熔点为26.5℃,易潮解。H3PO2的结构如图8-27所示,H3PO2分子中含有一个—OH,为一元中强酸,酸性强于磷酸的。
![]()
由于H3PO2分子中有两个P—H键,容易被氧原子进攻,因此,次磷酸及其盐都是强还原剂,特别是在碱性溶液中,还原能力更强。


图8-27 次磷酸分子的空间构型
卤素单质和重金属盐都能在溶液中将次磷酸或次磷酸盐氧化。

所以次磷酸盐常用于化学镀,将金属离子(如Ni2+等)还原为金属,在其他金属表面或非金属(塑料)镀件上沉积,形成牢固的镀层。
H3PO2及其盐都不稳定,受热歧化分解放出PH3。
![]()
纯的亚磷酸(H3PO3)为白色固体,熔点约74.4℃,在水中有很高的溶解度,亚磷酸结构如图8-28所示。分子中含有两个—OH,为二元中强酸,酸性强于磷酸。![]() =3.72×10-2,
=3.72×10-2,![]() =2.09×10-7,可以形成
=2.09×10-7,可以形成![]() 和
和![]() 两类盐。
两类盐。

图8-28 亚磷酸的空间构型
由于H3PO3分子中只有一个P—H键,因此,亚磷酸及其盐具有强还原性,![]() =-0.276 V,
=-0.276 V,![]() =-1.05 V,但弱于次磷酸及其盐。H3PO4能将Ag+、Cu2+等离子还原为金属。例如:
=-1.05 V,但弱于次磷酸及其盐。H3PO4能将Ag+、Cu2+等离子还原为金属。例如:
![]()
亚磷酸受热时能发生歧化反应,碱性条件下更易进行。
![]()
所以制备H3PO3要用P4O6和冷水反应。
氧化数为+5的磷的含氧酸包括正磷酸、焦磷酸、多磷酸和偏磷酸。P4O10吸水生成磷酸的反应很慢,一般生成偏磷酸、焦磷酸和磷酸等的混合物,只有在HNO3存在下煮沸水溶液,P4O10才能生成H3PO4。
![]()
正磷酸(H3PO4)一般简称为磷酸。H3PO4分子为四面体构型,分子中P原子采取sp3杂化,其中3个sp3轨道与羟基氧原子形成3个σ键,1个sp3轨道被孤电子对占据并与另一个氧原子形成1个σ配键,此氧原子上的两对孤电子对和P原子的两条3d轨道形成2个d-pπ配键(反馈键),使原来的π配键键长缩短、键能加大,接近双键。磷酸的分子结构如图8-29所示。

图8-29 磷酸分子结构
纯磷酸为无色晶体,熔点为42℃,沸点为407℃,属于高沸点酸。它能与水以任何比例互溶。市售磷酸是含85%H3PO4,相当于浓度为15 mol·dm-3的黏稠状的浓溶液,磷酸溶液黏度较大的原因与浓溶液中存在较多氢键有关。
磷酸是无氧化性、难挥发的三元中强酸。磷酸有三个—OH,磷酸的![]() =7.11×10-3,
=7.11×10-3,![]() =6.34×10-8,
=6.34×10-8,![]() =4.79×10-13。
=4.79×10-13。
磷酸有很强的配合能力,可以与很多金属离子形成可溶性配合物,如磷酸与Fe3+可以生成可溶性无色配合物H3[Fe(PO4)2]和H[Fe(HPO4)2],因此,分析化学中常用磷酸掩蔽Fe3+的干扰。
![]()
磷酸强热时发生脱水缩合反应,生成焦磷酸、三磷酸等多磷酸或偏磷酸,例如:

焦磷酸(H4P2O7)为无色黏稠液体,久置生成结晶,为无色玻璃状,在酸性溶液中会缓慢水解生成磷酸。
![]()
焦磷酸为四元酸,酸性强于正磷酸。![]()
![]()
常见的焦磷酸盐主要是M2H2P2O7和焦磷酸盐,由磷酸一氢盐加热脱水聚合而来。
![]()
分别往Cu2+、Ag+、Zn2+、Sn2+等盐溶液中加入Na4P2O7溶液,均有难溶的焦磷酸盐沉淀生成,当Na4P2O7过量时,过量的![]() 与这些金属离子形成配离子(如[Cu(P2O7)2]2-、[Mn2(P2O7)2]4-)而使沉淀溶解,这些可溶的配阴离子常用于无氰电镀。
与这些金属离子形成配离子(如[Cu(P2O7)2]2-、[Mn2(P2O7)2]4-)而使沉淀溶解,这些可溶的配阴离子常用于无氰电镀。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




