教学目标
1.掌握氢气的还原性。
2.依据氢气的性质了解氢气的重要用途。
3.从得氧、失氧的角度了解氧化还原反应的有关概念。
实验准备
课前准备的实验用品有:氢气的制取与氢气还原氧化铜的配套装置、水槽、小试管、酒精灯、火柴。
教学过程
引言:上一节课我们学习了氢气的可燃性,能在氧气(或空气)中燃烧,能在氯气中燃烧。
提问:请用文字表达式表示氢气和氧气的反应,指明反应所属的类型。
回答:氢气+氧气![]() 水。
水。
这个反应是两种物质生成另一种物质的反应,属于化合反应,又是物质跟氧发生的反应,又属于氧化反应。
讲述:氢气容易跟氧结合而生成水,这里的氧是单质氧。氢气能否跟氧化物中的氧结合生成水呢?比如氢气跟氧化铜能否发生反应?能反应,这是氢气的另一个重要的化学性质。
板书:二、氢气的化学性质
2.氢气跟氧化铜的反应
演示:实验(投影装置图)
先观察实验装置,它由两大部分组成,一部分是氢气发生器(用来制取氢气),另一部分是氧化铜和氢气的反应器。用酒精灯加热,使氧化铜和氢气在加热的条件下反应。两部分通过长的玻璃管连接起来,让产生的氢气进入反应器。
板书:实验装置:氢气发生器、氧化铜和氢气的反应器
讨论:氧化铜和氢气的反应器有什么特点?
问题:1.怎样固定盛有氧化铜的试管?为什么要这样做?
回答:试管口要略向下倾斜。加热固体时,为了防止加热时产生的水蒸气(药品中的水份或反应生成的水)在试管口冷凝后,倒流回热的试管底部,使试管破裂。
问题:2.在反应器部分,通氢气的导管插到什么位置?为什么?
回答:通氢气的导管要插到接近试管底部,在氧化铜的上方。这样,能保证排净试管内的空气,比较安全,还有利于氧化铜跟氢气充分接触,保证反应进行得比较迅速、完全。
问题:3.为了保证反应进行得比较迅速、安全,应怎样放置试管内的氧化铜?说明原因。
回答:氧化铜要在试管底部均匀铺开。这样能增加氧化铜跟氢气的接触机会,增大氧化铜的受热面积,保证反应进行得比较迅速、完全。
下面请同学们观察老师的操作顺序和反应现象,并做简要记录,同时思考为什么采用这样的操作程序,出现的现象说明什么问题。请两位同学到讲台上观察老师的操作,并在小黑板上作简要的记录。一个记录操作顺序,一个记录现象。(老师的演示动作要准确,不宜过快,做到边讲边演示。)
小黑板:(文字下方画线的是学生填写的内容)
(师生共同纠正同学的实验记录后,讨论为什么采取以上操作程序?从实验现象可以推出什么结论?)
问题:1.这个实验为什么要检验氢气的纯度?
回答:因为反应的条件是加热,混有空气的氢气在高温下可能发生爆炸。为了安全,需要检验氢气的纯度。
问题:2.为什么要先通一会儿氢气,再加热氧化铜?先加热,再通氢气可以吗?
回答:先通一会儿氢气,使试管内原有的空气完全排净,然后加热能保证安全。若先加热氧化铜,使试管内温度升高。这时试管内有空气,当氢气进入试管内跟空气混合,可能发生爆炸。
问题:3.当黑色氧化铜变红后,为什么应先停止加热,通氢气直到试管冷却(本题学生回答有困难时,可由教师讲解)?(https://www.xing528.com)
讲解:黑色氧化铜变红,红色的物质应是铜。多数金属在灼热时容易跟空气里的氧气反应,铜也不例外。为了防止生成的铜在灼热条件下接触空气中的氧气,重新变成氧化铜,要在停止加热后继续通氢气,直到试管冷却。
下面讨论实验现象。从试管口有无色液体生成,可推知有水生成。从黑色氧化铜变成红色光亮的物质,可推知另一种生成物是铜。所以这个反应的文字表达式是
板书: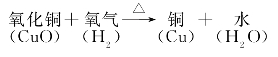
设问:这个反应属于哪一类反应?
讲述:从发生变化的物质种类看,它是置换反应。从物质跟氧元素的结合这一变化看(氧元素原来跟铜元素结合,变化后氧元素跟氢元素结合),应属于氧化还原反应。有关这类反应的知识,请大家阅读课本,在阅读时请思考下列问题。
投影:1.在氢气和氧化铜的反应中,什么物质发生还原反应?判断的依据是什么?
2.根据已学的氧化反应概念,在氢气和氧化铜反应中,什么物质发生氧化反应?
3.氧化反应和还原反应的区别是什么?你能找到两者之间的联系吗?
4.在氢气和氧化铜的反应中,什么物质是还原剂?判断的依据是什么?
5.从分析氢气和氧化铜的反应中,你能总结出还原剂和还原性的一般含义吗?
(学生讨论略。)
讲述:1.在该反应中,氧化铜发生还原反应,它被还原。判断的依据是氧化铜失去氧而变成铜单质。含氧物质里的氧被夺去的反应是还原反应。
2.在该反应中,氢气夺取氧化铜里的氧,跟它化合成水。氢气发生氧化反应,物质跟氧结合的反应是氧化反应。
3.还原反应和氧化反应的区别就在于变化中是失氧还是得氧。这是两种相反的变化。氧原子在反应前后既不增加,也不减少,因而在反应中有一种物质得氧,必然有一种物质失氧。所以氧化反应和还原反应一定同时发生在同一个反应中。
4.氢气在反应中得氧,它使氧化铜失去氧,它是还原剂。
5.得氧的物质必然使其他物质发生失氧的变化,这种物质是还原剂。还原剂是指含氧物质发生还原反应的物质。还原剂有夺氧的能力,易跟氧结合。具有夺氧能力的物质,叫做还原剂。
板书:
讲述:氢气具有还原性,它能夺取单质氧气中的氧,也能夺取氧化铜等含氧化合物中的氧。如
在这个反应中,氢气也作为还原剂,显示还原性。所以氢气的重要化学性质之一是有还原性。
总结氢气的化学性质:氢气具有可燃性和还原性。
根据氢气的性质,容易了解它的用途。请看课本。
问题:请同学们说出这些用途分别利用氢气的哪些性质。
小结:1.氢气球——密度小
2.高能燃料、氢氧焰——可燃性
3.制备金属材料(如硅)——还原性
4.制盐酸、合成氨——氢气能和多种物质反应
思考作业:依据氧化反应和还原反应的对应关系,氧化铜在反应中用做什么剂?它有什么性质?
教学说明
1.为了培养学生的实验观察能力,通过氢气还原氧化铜这一实验,使学生明确实验观察的内容和方法。观察一个实验的内容包括实验装置、实验操作和实验现象。教师要求学生观察实验时必须思考,帮助学生掌握在观察中思考和在思考中观察的方法。
2.利用思考题帮助学生阅读教材,培养在阅读时多思考的良好习惯,初步学习比较、归纳、演绎的思维方法。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




