对系统进行热力分析,主要就是分析系统与外界相互作用时所传递的能量并计算它们的数值。对封闭系统而言,能量传递的方式有两种,即作功和热传递。
一、功
1.功的热力学定义
在力学中,功的定义为力与同方向位移的乘积,对于变力作的功为
微元功为
上式中“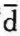 w”表示微元功,不是全微分。
w”表示微元功,不是全微分。
但是,在热力学中,经常遇到的是气体膨胀的情况,它的位移难以确定。因此,当用宏观的观点处理热力学问题时,将功的定义和系统与外界之间的相互作用效果联系起来。如图3-1所示,在气缸中有一定质量的高压气体。当高压气体膨胀时,活塞向右移动,通过曲柄连杆机构可以使一重物升起。取高压气体为封闭系统,活塞、曲柄连杆机构和重物都是外界。当系统膨胀时,系统通过边界,和外界发生了功的相互作用,其惟一的外界变化就是重物的升起(不计活塞、曲柄连杆的质量)。因此,在热力学中,可以把功定义为:
“当封闭系统通过边界,和外界之间发生相互作用时,如外界的惟一效果是升起重物,则系统对外界作了功;反之,如外界的惟一效果是降低重物,则外界对系统作了功。”
功的热力学定义给出了系统与外界是否发生了功的相互作用的判据,这就是外界是否升起或降低重物,而且功的数值也可以根据重物的升起或降低来计算。按传统习惯,规定系统对外界作功为正,而外界对系统作功为负。系统对外界作功也可以是使外界的弹簧受到压缩,这时可以把弹簧的压缩折合为重物的升高。因此,外部的惟一效果是重物的升起或降低,这可以是实际发生的,也可以是折合的。
图3-1 封闭系统作功
与系统只发生功的相互作用的外界,称为“功源”。从功的热力学定义还可看出,功是系统和外界之间能量传递的一种方式,或者说,功是传递中的能量。它只在通过边界时出现,一旦这种传递中的能量通过了边界时,它便“消失”了并转化为系统或外界的能量,因此,说系统“具有”多少功是没有意义的,即功不是系统的状态参数。功只是系统发生变化时在其边界上出现的参数,功的数值与状态变化所经历的途径有关。
2.体积功
工质体积改变时所作的功称为体积功。工质膨胀时对外界作的功称为膨胀功;反之,工质被压缩时,外界对工质所作的功称为压缩功。
如图3-2所示,在气缸中有1kg工质,把它选为所研究的封闭系统。当工质从初态1沿过程1A2膨胀到终态2时,系统对外界作的功称为单位质量膨胀功,以符号w表示,单位为J/kg或kJ/kg。现对w计算如下。
设气缸内压力为p,作用在活塞右边的外界压力为pout,活塞面积为A,则外界作用在活塞右边的总力为poutA,气缸与活塞间的摩擦力为Ff。当工质作微元膨胀时,活塞向右移动的距离为dx。因摩擦力与活塞移动方向相反,所以膨胀时,系统的总压力p A,poutA与Ff三者之间的关系为(p-pout)A=Ff。这时,系统对外界作的微元膨胀功 w(因为功不是状态参数,微元功用
w(因为功不是状态参数,微元功用 w表示,以与全微分区别)为
w表示,以与全微分区别)为
图3-2 封闭系统的膨胀功
式中,Adx=dυ为工质在微元膨胀时比体积的变化,所以(https://www.xing528.com)
系统本身膨胀功为
系统本身膨胀功与系统对外界所作的膨胀功之差为
摩擦力乘位移为摩擦功。在准静态过程1A2中,系统的膨胀功减去摩擦功才是系统对外界作的膨胀功。当气缸与活塞之间的摩擦力等于零时,系统的内外压力随时相等,则过程1A2不仅是准静态的,而且是可逆的。于是,对可逆过程有
如可逆过程1A2中压力随比体积的变化关系p=f(υ)已给定,代入上式,则单位质量膨胀功为
可见,可逆过程的单位质量膨胀功可以用p-υ图中过程曲线下的面积表示。准静态过程曲线下的面积只能表示系统本身作的膨胀功,而可逆过程曲线下的面积才是系统对外界作的膨胀功。由于摩擦功wf总是取正值,所以在系统状态参数经历的变化相同时,可逆过程中对外界作的膨胀功最大。
从图3-2可以看出,当初态1和终态2给定时,可逆过程可以沿不同的途径进行,如1A2、1B2和1C2等。与之相对应的,必有不同数值的膨胀功,如面积1A2341、面积1B2341、面积1C2341,而且还和过程有关,即功不是状态参数,而是过程函数。
在可逆过程中,封闭系统与外界有无功的相互作用以及功交换的方向,可由式(3-7)判断。当dυ=0时, w=0,即工质的比体积不变,系统与外界没有功的相互作用。当dυ>0时,
w=0,即工质的比体积不变,系统与外界没有功的相互作用。当dυ>0时, w>0,即工质膨胀时,系统对外界作膨胀功。反之,当dυ<0时,
w>0,即工质膨胀时,系统对外界作膨胀功。反之,当dυ<0时,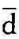 w<0,即工质被压缩时,外界对系统作压缩功,压缩功可以理解为负的膨胀功。
w<0,即工质被压缩时,外界对系统作压缩功,压缩功可以理解为负的膨胀功。
如封闭系统中工质的质量为mkg,因体积是尺度量,对于均匀系统V=mυ,则可逆过程中系统对外界作的膨胀功为
式中,W的单位为J或kJ。
二、热量
外界对系统作功可以增加其能量。此外,外界对系统加热也可以增加其能量。可见,功和热是改变系统能量的两种方式。在热力学中,热量的定义为:
“热量是除功以外,通过边界由外界传递给封闭系统的能量。”
按习惯,规定外界加给系统的热量为正,而系统给外界的热量为负。与功类似,热量也是传递中的能量。它只在通过边界时出现,一旦这种传递中的能量通过了边界时,它便“消失”了并转化为系统或外界的能量。因此,说系统“具有”多少热量是没有意义的,热量也不是系统的状态参数。它的数值与系统状态变化途径有关。
与系统只发生热的相互作用的外界,称为“热源”,而且认为热源的热容量足够大,以致热源放热或吸热时其温度保持不变。
但是热量与功有着本质上的区别。功是由于外界重物的升降(真实的或折合的)而产生的系统与外界的相互作用,它是规则运动的能量传递方式。热量是传递中的总能量扣除规则运动传递后的剩余部分。例如,外界加给系统的能量为10kJ,其中外界对系统作功为4kJ,这样,外界加给系统的热量为6kJ。由经验得知,热量总是从高温处自发地传到低温处,温度差是热量传递的驱动力。按分子运动论观点,温度是物质内部分子热运动剧烈程度的度量。因此,热量是不规则热运动的能量传递方式。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




