1.导体
能导电的物质称为导电体,简称导体。导体大体上可分为两类,第一类导体是电子导体,例如金属、石墨及某些金属的化合物(如WC)等;第二类导体是离子导体,例如电解质溶液或熔融的电解质等。
第一类导体(电子导体)靠自由电子的定向运动而导电,在导电过程中自身不发生化学变化,当温度升高时由于导电物质内部质点的热运动加剧,阻碍自由电子的定向运动,因而电阻增大,导电能力降低;第二类导体(离子导体)依靠离子的定向运动(即离子的定向迁移)而导电,当温度升高时,由于溶液的黏度降低,离子运动速度加快,以及在水溶液中离子水化作用减弱等原因,导电能力增强。
当原电池或电解池中有电流通过时,第一类导体中的电子和第二类导体中的离子在电场的作用下都作定向移动。在电解质溶液(或熔融态的电解质)中电流的传导是通过离子的定向移动而完成的,阴离子总是移向阳极(不一定是正极),而阳离子总是移向阴极(不一定是负极)。当阴、阳离子分别接近异性电极时,在电极与溶液接触的界面上分别发生电子的交换(离子或电极发生氧化或还原反应)。电流在溶液中的传导由阴、阳离子的移动共同承担。
例如,用惰性电极施加一定外电压进行电解。
(1)电解CuCl2溶液
在阴极(还原作用):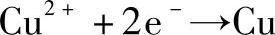
在阳极(氧化作用):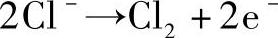
(2)电解Na2SO4溶液
在阴极: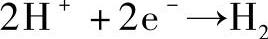
在阳极: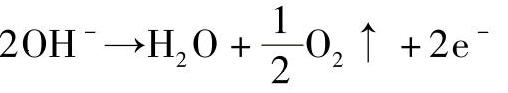
在Na2SO4溶液中正离子H+较Na+更易于在阴极放电,Na+只是移向阴极但并不在阴极放电。同样在阳极上起作用的是水溶液中的OH-,而不是SO24-,但SO24-也移向阳极而参与导电。在电极上进行的反应与电解质的种类、溶剂的性质、电极材料、外加电源的压力、离子浓度、温度等有关。
离子导体不能单独完成导电任务,必须与金属导体接触而形成金属-电解质溶液-金属串联系统,才能得以完成导电任务。可见,电流连续不断地通过溶液是通过溶液中离子向电极定向迁移和离子在两类导体界面上发生电化学反应来实现的。
2.电化学反应
在反应过程中有电子转移的反应称为氧化还原反应。对于一个氧化还原反应,例如

失去电子的物质(Zn)称为还原剂,得到电子的物质(Cu2+)称为氧化剂。氧化剂从还原剂中获得电子,使自身的化合价降低,这个过程称为还原;相应的,还原剂则由于给出电子而使自身的化合价升高,这个过程称为氧化。所以上述反应是由两个半反应构成的,即
氧化半反应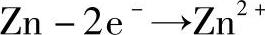
还原半反应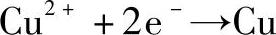
我们把元素的高价态称为氧化态,它可以作为氧化剂而获得电子;把元素的低价态称为还原态,它可以作为还原剂而给出电子。这样,氧化半反应就是元素由还原态变为氧化态的过程,而还原半反应则是由氧化态变为还原态的过程。一个氧化还原反应便可以一般地表示为
氧化态Ⅰ+还原态Ⅱ→还原态Ⅰ+氧化态Ⅱ
由此可以看到:在氧化还原反应中,氧化与还原是共存共依的,在一定条件下又可以相互转化。
为了使电流流过电解质溶液,需将两个第一类导体作为电极浸入溶液,使电极与溶液直接接触。当电流流过溶液时,正、负离子分别向两极移动,同时在电极上有氧化还原反应发生。在电极上进行的氧化还原反应称为电化学反应。
若利用特定装置,使电子的传递通过导体进行,便可产生电流,使化学能转变成电能。这种借助氧化还原反应产生电流,将化学能转变为电能的装置称为原电池,如图1-16a所示。若外加电流通过电解质溶液(或熔融态的电解质)来引起氧化还原反应的发生则称为电解,我们把借助电流实现上述过程,即将电能转变为化学能过的装置称为电解池,如图1-16b所示。
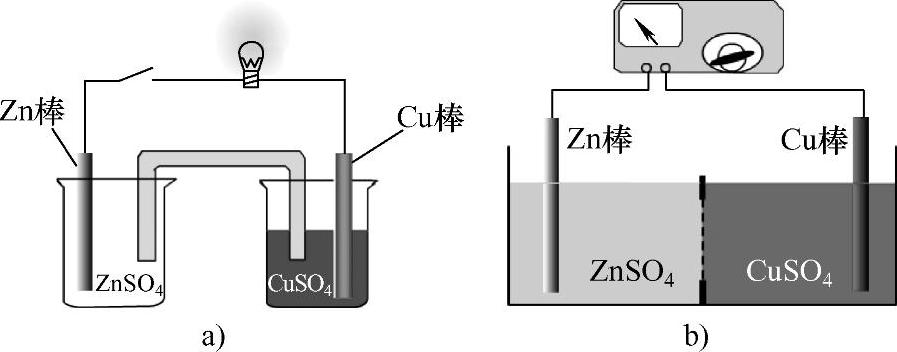
图1-16 原电池和电解池
a)原电池 b)电解池
无论是原电池还是电解池,总是把电位较低的电极称为负极,把电位较高的电极称为正极。电流总是由正极流向负极(根据电学中的规定,电子的流向和电流的方向刚好相反)。另外,把在其上面发生氧化反应的电极称为阳极,发生还原反应的电极称为阴极。所以在电解池中,与外加电源负极相接的电极接受电子,电位较低,发生还原反应,该电极是负极也是阴极;与外加电源正极相接的电极电位较高,发生氧化反应,该电极是正极也是阳极。而在原电池中,情况则不同,以丹尼尔电池(铜锌原电池)为例,这种电池用金属锌和金属铜作电极导体。锌电极放入Zn-SO4溶液中,铜电极放入CuSO4溶液中。两个电极导体用导线连接起来,其中还要串联一个检流计以便观察电流的产生和电流的方向。两个电解质溶液用盐桥联系起来,电路中的检流计指针发生偏转,电流方向是由铜电极流向锌电极(即电子由锌电极流向铜电极)。锌电极发生氧化反应是阳极,但它输出多余的电子,电位较低,所以锌电极也是负极,而铜电极发生还原反应是阴极,它接受电子,电位较高,所以铜电极是正极。
3.电极反应
铜锌原电池由三个部分组成:两个半电池——锌棒和锌盐溶液、铜棒和铜盐溶液;金属导线;盐桥。
半电池是原电池的主体,每一个半电池都是由同一种元素不同氧化数(化合物分子中某元素的形式电荷数)的两种物质组成的,即电极导体(如Zn)和电极溶液(如ZnSO4)。电极导体和电极溶液组成了电极(即半电池)。在半电池中进行着氧化态和还原态相互转化的电极反应,即
氧化态+ze-→还原态
在铜锌原电池中,电子由锌电极经由导线流向铜电极,其电极反应为
锌电极(负极)Zn-2e-→Zn2+
铜电极(正极)Cu2++2e-→Cu
同一元素的氧化态物质和还原态物质构成了氧化还原电对。其符号为Zn2+/Zn、Cu2+/Cu,其通式为氧化态/还原态。氧化还原电对表示了氧化态和还原态之间的相互转化、相互依存关系。
连接两极溶液的倒置U形管称为盐桥,管内充满了含电解质溶液(一般为饱和KCl溶液)的琼脂。其作用是连通原电池的两个半电池间的内电路,使两个半电池保持电中性,这样电流才可以不断产生。
图1-16a所示的铜锌原电池可以用下述电池符号予以简明表示:
(-)Zn︱ZnSO4(水溶液)‖CuSO4(水溶液)|Cu(+)其中,“|”表示有界面电位存在,“‖”表示两溶液之间的液体接界电位已消除。当用导线将铜棒、锌棒和电流表、负载串联起来接通时,即有电流通过。由于锌电极的电位低于铜电极的电位,从外电路来看,电流从铜电极流向锌电极(电子则从锌电极流向铜电极)。
锌电极作为阳极,发生氧化反应
Zn→Zn2++2e-
锌电极上锌原子放出电子变成Zn2+进入溶液,锌电极上积累的电子通过导线流到铜电极。
铜电极作为阴极,发生还原反应
Cu2++2e-→Cu(https://www.xing528.com)
合并两个半反应,即可得到整个原电池所发生的氧化还原反应,称为电池反应,即
Cu2++Zn→Cu+Zn2+
任何一个原电池都是由两个电极构成的。构成原电池的电极有四类,见表1-5。
表1-5 电极类型
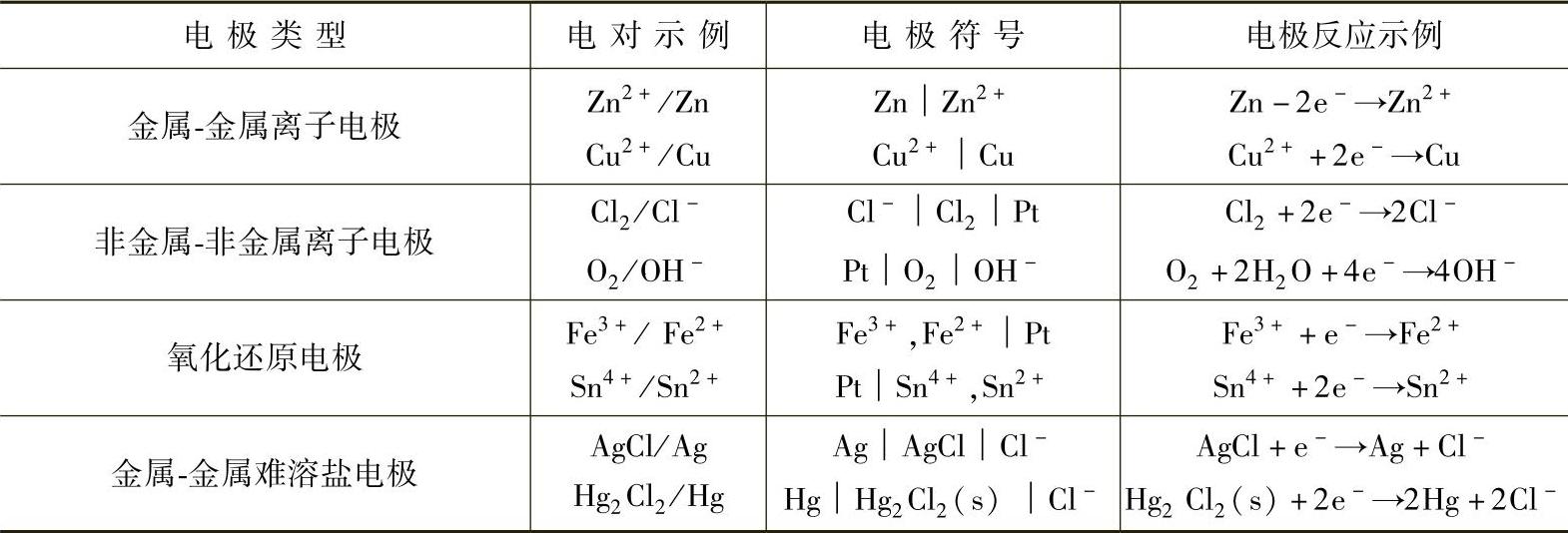
注:上述金属-金属离子电极是以金属本身作为电极的导体,而其他类型的电极则常用铂或石墨等辅助电极作为电极导体。它们仅起吸附气体和传递电子的作用,不参加电极反应,所以又称为惰性电极。
在电池工作期间,作为阳极的锌棒不断被腐蚀,而溶液中的Cu2+则不断被还原。此时,原电池中产生的电流是由两极之间的电位差引起的,所以电池的电位差是电极反应的驱动力。原电池中两个电极的开路电压(即开路电位差)称为原电池的电动势,以E表示。其大小表示氧化还原反应的驱动力大小,由于电流是从阴极流向阳极,所以阴极电位高为正极,阳极电位低为负极。原电池的电动势是正、负两个电极的相对电位差,即
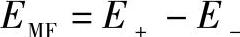
或
式中 E+、Ec——正极、阴极的电位;
E-、Ea——负极、阳极的电位。
4.双电层及电极电位
(1)双电层 在两种不同物质的界面上,正、负电荷分别排列成两层。在溶液中,固体表面常因表面基团的解离或自溶液中选择性地吸附某种离子而带电。由于电中性的要求,带电表面附近的液体中必有与固体表面电荷数量相等但符号相反的多余反离子。带电表面和反离子构成双电层。热运动使液相中的离子趋于均匀分布,带电表面则排斥同号离子并将反离子吸引至表面附近,溶液中离子的分布情况由上述两种对抗作用的相对大小决定。根据斯特恩的观点,一部分反离子由于电性吸引或非电性的特性吸引作用(例如范德华力)而与表面紧密结合,构成紧密层(图1-17)。其余的离子则扩散地分布在溶液中,构成双电层的扩散层。由于带电表面的吸引作用,在扩散层中反离子的浓度远大于同号离子。离表面越远,过剩的反离子越少,直至在溶液内部反离子的浓度与同号离子相等。
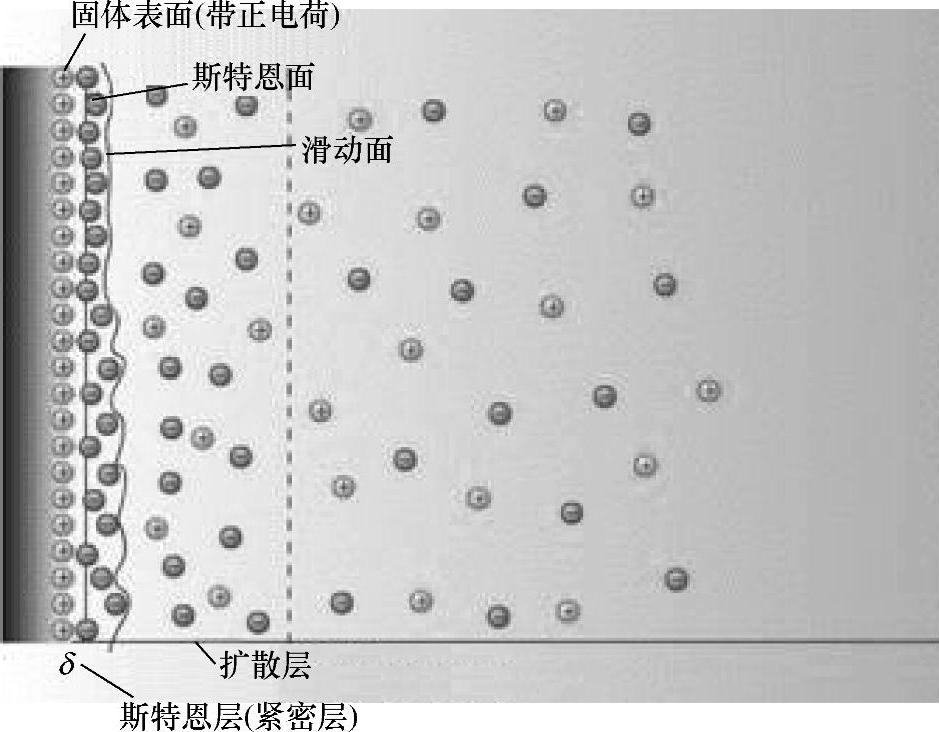
图1-17 斯特恩双电层模型
金属晶体点阵上的质点离开点阵成为离子需要外界做功。当金属与电解质溶液接触时,若金属表面的金属正离子受到溶液中极性分子的水化作用,且该作用足以克服晶体中原子间的结合力,则金属正离子就会进入溶液成为水化阳离子,而金属表面产生电子积集而带负电,于是在金属与溶液界面上形成双电层(图1-18a)。锌、镉、镁、铁等在酸、碱、盐类的溶液中均会形成这样的双电层。反之,若金属表面与电解质溶液的相互作用不能克服金属晶体原子间的结合力,就不能使金属离子脱离金属,于是电解质中的金属正离子沉积在金属表面令其带正电,而紧靠金属表面的溶液积集阴离子带负电,从而形成双电层(图1-18b)。在电解质溶液中,当一些正电性金属或非金属(如石墨)既不能水化成正离子,也无金属离子沉积于其上时,则会形成第三种双电层。如将铂放入溶解有氧的水溶液中时,铂上将吸附一层氧分子或氧原子,氧从铂上取得电子并与水作用生成氢氧根离子,使溶液带负电,而铂金属失去电子带正电,形成双电层(图1-18c),这种电极称为氧电极。当溶液中有足够的氢离子时,也会夺取铂的电子,使氢离子还原成氢,此时金属铂带正电,而紧靠金属的液层带负电,这种双电层构成的电极称为氢电极。
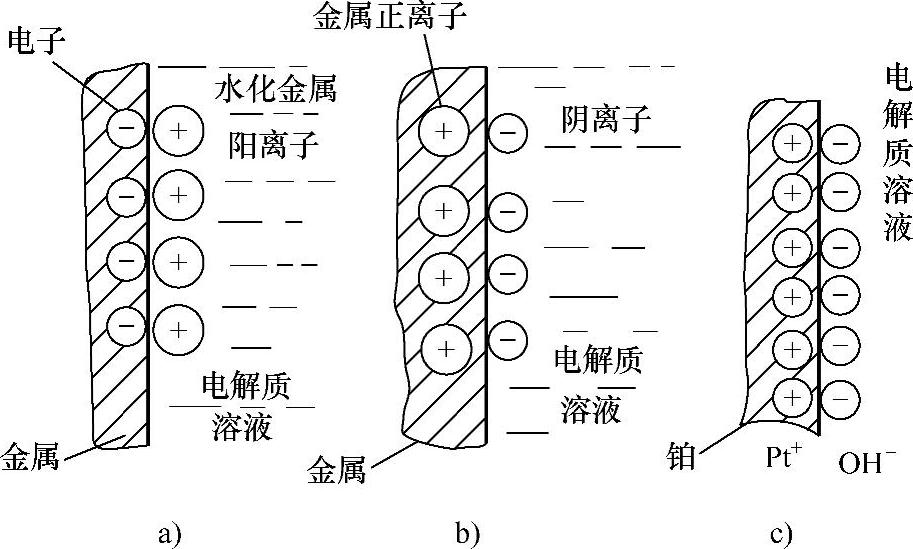
图1-18 金属双电层示意图
(2)电极电位 由于双电层的存在,金属与溶液产生电位差,此电位差就称为该金属在该溶液中的电极电位。这种电位差目前无法测量和计算,只能采用间接的方法测量,通过与特定的参比电极组成无液体接界电位的电池测量其开路电压或电动势,从而表征电极体系氧化-还原能力的相对电极电位。采用任一电极M与标准氢电极(简写为SHE)组成无液体接界电位的电池,则M电极的电极电位即为此电池的开路电压,即

式中 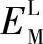 、
、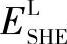 ——M电极和标准氢电极导线引出线的内电位;
——M电极和标准氢电极导线引出线的内电位;
EO——电极电位;
V——电池的开路电压,其正负号与M电极在此电池中导线的极性相同。
标准氢电极是将镀有一层蓬松铂黑的铂片放到aH+=1mol·L-1的溶液中,通入分压为100kPa的纯氢气构成的,如图1-19所示。氢气吸附于铂片上,氢气与溶液中的氢离子之间建立起平衡,将它的电位规定为零,即φθ(H+/H2)=0.0000V。比标准氢电极电位负的金属,称为负电性金属。负电性强的金属,容易受腐蚀。比标准氢电极电位正的金属,称为正电性金属。
(3)平衡电极电位 当金属成为阳离子进入溶液的速率和溶液中的金属离子沉积到金属表面的速率相等时,即正、逆过程的物质迁移和电荷运送速率都相同时,反应达到动态平衡,该电极上具有一个恒定的电位值。因为处于热力学平衡状态的电极体系(可逆电极),由于氧化反应和还原反应速率相等,电荷交换和物质交换都处于动态平衡之中,因而净反应速率为零,电极上没有电流流过,即外电流等于零,这时的电极电位就是平衡电极电位或可逆电位。用对消法(在外电路上加一个方向相反而电动势几乎相同的电池)测定该电池的电动势,如图1-20所示,这个电池电动势的数值和符号就是待测电极的电极电位的数值和符号。测得的电极电位称为还原电位,即:氧化型+ne-→还原型。
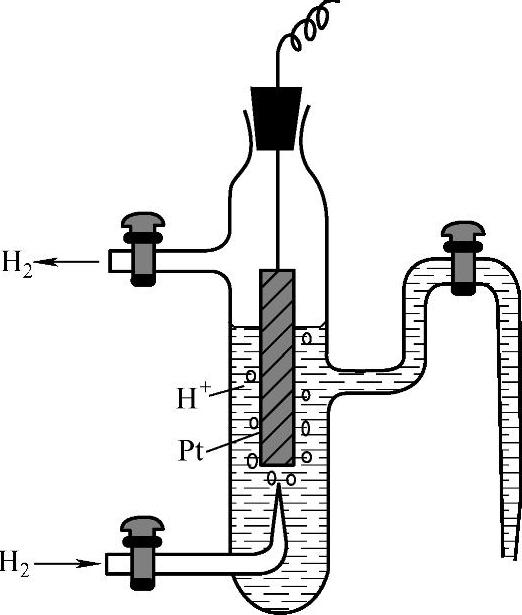
图1-19 标准氢电极的构造图
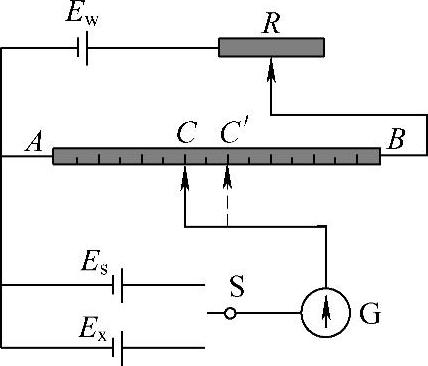
图1-20 对消法测定电池电动势的原理图
电池的电动势等于正极的电极电位减去负极的电极电位,即待测电极的电位与标准氢电极电位之差,应为

一定温度下,金属离子的活度为1mol·L-1,参与电极反应的各物质均具有标准态时测得的平衡电极电位,称为标准电极电位,用φθ表示。附录A、B中列举了一些常用的标准电极电位。
平衡电极电位的大小与金属离子的浓度、温度等因素有关,其近似值可由能斯特(Nernst)平衡电极电位方程式表示,即
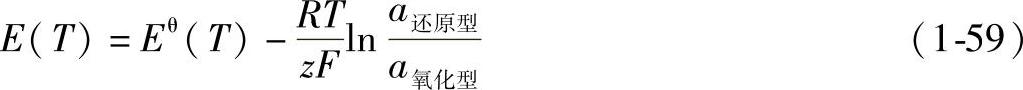
式中 E——平衡电极电位;
Eθ——金属的标准电极电位;
R——摩尔气体常数,8.314J·mol-1·K-1;
T——热力学温度(K);
z——金属的离子价数;
F——法拉第常数,96500C·mol-1;
a还原型——电极反应中还原型一侧各物种的活度(溶液较稀时可近似用浓度代替)或分压的反应系数次方的乘积;
a氧化型——电极反应中氧化型一侧各物种的活度(溶液较稀时可近似用浓度代替)或分压的反应系数次方的乘积,纯固体、纯液体不出现在对数项中。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




