一、新授课
1.趣味设问
新授课首先要引起学生的学习热情,所以可多用趣味性较强的设问。
【案例】学习《原电池》原理时,可以用讲故事的方式设问。
利用多媒体展示漫画“格林太太的假牙”:格林太太有两颗假牙,一颗是黄金的,是富有的象征;另一颗是不锈钢的,是一次车祸所留。令人不解的是,自从车祸以后,格林太太经常头疼,夜间失眠,心情烦躁……这是为什么呢?医生百思不得其解。后来,一位化学家揭开了谜底。请问化学家发现了什么?格林太太的病因是什么?学习了“原电池”这节课后,大家就会明白了。
这样的设问,能使学生产生强烈的求知欲,学得生动、活泼、高效。
2.实验设问
【案例】Na与H2O反应的学习中,可设计以下的学习过程:
演示实验:Fe+CuSO4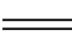 Cu+FeSO4,并复习反应原理。
Cu+FeSO4,并复习反应原理。
提问:请推测Na与CuSO4溶液反应吗?生成物是什么?请写出相应的化学反应方程式。
学情:大部分学生认为Na投入到CuSO4溶液中,与Fe和CuSO4溶液的反应类似,Na能将Cu置换出来。
演示实验:Na与CuSO4溶液的反应。
提问:为什么没有红色的Cu生成?蓝色沉淀是什么?无色气体是什么?
演示实验:Na与H2O的反应。
教学活动:以实验为基础,讨论、分析、解决以上问题。
以化学实验为中心,教师设置问题,学生心存疑问,课堂释疑,这样的教学过程,学生的思维处于高度集中的状态,极大地调动了学习的积极性和探究热情。
3.梯度设问
新授课中,设问要恰当地把握学生的“最近发展区”。所谓“跳一跳,摘到桃”,设问不能太大、太难,学生摸不着边际,无从答起;也不能太小、太易,学生不假思索就能回答,失去设问的意义。同时,设问要考虑新旧知识的衔接和过渡,问题设置要有梯度,符合学生的认知规律,有利于学生逐步深入学习。
【案例】在学习实验室制Cl2的原理时,可依次设问如下:
(1)反应物是用NaCl溶液还是盐酸?为什么?
(2)是用浓盐酸还是稀盐酸?为什么?
(3)除了MnO2,实验室制Cl2还可以用哪些常见氧化剂?
(4)若氧化剂分别为MnO2或KMnO4,反应条件是否相同?若不同,说明了什么?
以上设问,引导学生运用所学氧化还原反应原理思考解决问题,温故知新,有助于学生形成完整的知识体系。
二、复习课
1.以点带面设问
复习课中,设问要帮助学生将所学知识条理化、系统化,促进知识网络的形成。在设问时,要注重从某一点出发,发散设问,将知识点“串成线,连成面”,即以点带面设问。
【案例】在复习课中,从“酸”这个点出发,设置这样一些问题:
(1)高中化学学习了哪些常见的酸?请写出它们的化学式。
(2)请分析:在发生酸碱中和反应时,怎样的酸既可以生成正盐,又可以生成酸式盐?从反应物量的角度考虑,生成正盐和酸式盐的条件分别是什么?正盐和酸式盐之间如何进行相互转化?请举例说明。
(3)常见的弱酸有哪些?判断酸是否为弱酸,常用的方法有哪些?
(4)常见的高沸点酸有哪些?它们可以在实验室制取什么气体?制取原理是什么?
……
对于“酸”的复习,还可以从酸的溶解性、稳定性、氧化性强弱等角度进行设问。
以上设问,可引导学生复习与量有关的化学反应及相应离子方程式的书写,强弱电解质的区别,弱电解质的电离平衡,硫酸制气等一系列重点、难点知识。在综合性的复习课中,这样的设问方式可帮助学生将知识“联网”,收到较好的复习效果。
2.层层递进设问
在复习课中,设问的主要目的之一就是帮助学生攻克难点问题,深入理解所学知识。对于重要的、有难度的学习内容,可采用依次递进,一环扣一环的方式设问,引领学生对知识的理解逐步深入。
【案例】关于物质的量“n”的计算复习,可设问如下:
(1)求算“n”的常见途径有哪些?(https://www.xing528.com)
(2)每条途径对气、液、固三态物质均适用吗?
(3)关于气体的计算是否一定要考虑温度和压强?请具体分析。
这样的设问,一方面帮助学生理清思路,将所学零散知识“串”起来;另一方面,可以对容易出错、理解不到位的学习内容加以强化,避免认识上的偏差。
3.围绕核心设问
复习课中,设问的面要广,跨度要大,但也不能因此而失去核心。教学中的设问,不能漫无目的,东拉西扯,而是要围绕核心,突出重点,突破难点。
【案例】在电解质溶液的学习中,H2O的电离是核心。学生若真正理解了H2O的电离,很多难点问题就能迎刃而解。在相关的复习中,我们可以设置这样的系列问题:
(1)常温下,在0.1mol/L盐酸和0.1mol/LNaOH溶液中,由水电离出的c(H+)分别为多少?
(2)以上计算说明加酸或加碱时,对H2O的电离产生怎样的影响?其影响程度的大小由什么决定?
(3)常温下,pH=8的CH3COONa溶液和pH=5的NH4Cl溶液中,由水电离的c(H+)分别为多少?
(4)以上计算说明盐类水解对H2O的电离会产生怎样的影响?
(5)影响H2O的电离的因素有哪些?其中哪些因素会影响水的离子积常数?
(6)常温下,若由水电离的c(H+)=1×10-13mol/L,溶液的酸碱性是怎样的?若由水电离的c(H+)=1×10-5mol/L,溶液的酸碱性又是怎样的?
以上设问围绕的核心就是H2O的电离,涉及电离平衡、pH计算、盐类水解等很多重要知识。这样多角度,但又围绕核心的设问,对相关知识和原理进行了充分挖掘,对学生透彻理解重点和难点知识很有帮助。
三、习题课
1.“举一反三”设问
习题课中,为了锻炼学生的思维能力,可采用针对一个问题多角度、多变化的设问方式。这样“举一反三”,对于学生认知学习内容和学习能力的提高非常有益。
【案例】为了让学生充分理解溶液中离子浓度之间的关系,以CH3COOH与NaOH的反应为例,设计如下问题:
(1)常温下,在CH3COONa溶液中,各离子浓度由大到小的排序是怎样的?
(2)常温下,将0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,反应后溶液中离子浓度由大到小如何排序?
(3)常温下,将pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合,反应后溶液中离子浓度由大到小如何排序?
(4)CH3COOH与NaOH溶液反应后,溶液的酸碱性有几种可能?若溶液显中性,各离子浓度的大小关系是怎样的?
……
在化学习题课中,围绕一个问题“举一反三”,多角度变化设问,可使学生真正理解所学知识,达到事半功倍的学习效果。
2.针对学习中的“盲点”设问
习题课中,要利用学生知识结构中的“盲点”进行设问,对学生容易“模糊”的学习内容和易错点进行强化训练。这样,学生在习题处理的过程中,能在设问引导下进行反思,澄清模糊的认识,提高思辨能力。
【案例】在学习硝酸时,可设置下列问题:
(1)铝或铁放入常温下的浓硝酸中,有明显的现象吗?若无明显的现象,怎样判断是由于“钝化”,还是因为未发生反应呢?
(2)铜片放入稀硫酸中会溶解吗?在稀硫酸中加入硝酸盐,如NaNO3等,能将铜片溶解吗?请分析相应的原理。
(3)将19.2g铜片放入100mL,浓度均为2mol/L的硫酸和硝酸混合液中,有多少克铜溶解?生成的气体在标准状况下的体积为多少升?
对于硝酸这种重要物质的学习,学生可能存在较多的知识遗漏和理解偏差。针对学生可能存在的认知盲点和知识漏洞设问,可以促进学生对所学内容的真正理解,学生的认知水平能有较大提高。
3.开拓思路,对比设问
在习题课中,多采用对比设问,能让学生的思路更开阔,理解更透彻,不断提高解决问题的能力。
【案例】在金属钠的学习中,可设置这样一组问题进行训练:
(1)把8gNaOH溶于92g水中,所得溶液溶质的质量分数为多少?
(2)把4.6g钠放入95.6g水中,所得溶液溶质的质量分数为多少?
(3)把6.2gNa2O溶于93.8g水中,所得溶液溶质的质量分数为多少?
(4)把7.8gNa2O2放入93.8g水中,所得溶液溶质的质量分数为多少?
这组设问,强调了溶质质量分数计算时应特别注意的几个方面。比如,要分析物质溶于水时可能发生的化学反应,明确真正的溶质是什么,要学会应用质量守恒定律计算溶液质量等。同时,学生通过这些习题,可进一步熟悉和应用重要的化学反应。习题课中的对比设问不是单纯的就题论题,而是通过对比分析,学生更为全面、深刻地理解所学知识,灵活应用所学原理。在高中化学教学中,不仅在习题课中,在其他教学过程中也应更多地运用对比设问。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




