(第9题图)
(第10题图)
10.(2020·徐汇·二模)25℃时,同体积、浓度均为0.10mol·L-1的CH3COOH溶液和HX溶液,分别与同体积0.10mol·L-1NaHCO3溶液混合,产生CO2的体积随时间变化如图所示,下列说法错误的是( )。
A.原溶液中c(H+):HX溶液>CH3COOH溶液
B.与CH3COOH反应结束后的溶液中,c(Na+)>c(CH3COO-)
C.反应结束后的两溶液中,c(CH3COO-)<c(X-)
D.由该实验可知HX为强酸
11.(2020·长宁、金山·一模)中国科学家用金属钠和CO2在一定条件下制得了金刚石:![]() 副产物Na2CO3溶于水后溶液呈碱性,请结合平衡移动的原理,用文字描述所得溶液呈碱性的原因。
副产物Na2CO3溶于水后溶液呈碱性,请结合平衡移动的原理,用文字描述所得溶液呈碱性的原因。
14.(2020·宝山·一模)某研究性学习小组制备高铁酸钾(K2FeO4)并探究其性质。查阅文献,得到以下资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。甲同学取少量K2FeO4加入浑浊的泥浆水中,发现产生气体;搅拌,浑浊的泥浆水很快澄清。请简述K2FeO4的净水原理。
___________________________________________________________________________________。
15.(2020·宝山·二模)氨的水溶液叫做氨水,它可作为化学肥料。实际使用时,因为有很多不便,所以往往制成铵盐。NH4Cl就是常见的铵盐,NH4Cl属于_________晶体,长期使用含NH4Cl的氮肥会使土壤_________(填“酸”或“碱”)化,请结合有关方程式说明原因。
___________________________________________________________________________________。
20.(2020·长宁·二模)常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH见下表。
(第20题表)
完成下列填空。
(1)①中所得混合溶液,pH_________7(填“>”“<”或“=”);②中c_________0.2(填“>”“<”或“=”),所得混合溶液中各离子浓度大小关系为______________________________________________。
(2)请设计一个能证明一水合氨是弱电解质的简要方案。
_______________________________________________________________________________。
21.(2020·松江·二模)磷酸氯喹(C18H32ClN3O8P2)是当前治疗新型冠状病毒的药物之一,而碳、氮、氯、磷等是其重要的组成元素。
完成下列填空。(https://www.xing528.com)
(1)已知磷酸是弱电解质,它的分子式为H3PO4。其酸式盐Na2HPO4的电离方程式是__________________________。经测定Na2HPO4的水溶液呈弱碱性,请用学过的化学知识进行解释。
_______________________________________________________________________________。
(2)常温下,在CH3COONa溶液中加入一定量的HCl,使其pH=7,则c(Cl-)_________c(CH3COOH)(填“>”“<”或“=”)。
22.(2020·徐汇·二模)乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。草酸溶液中微粒的物质的量分数随溶液pH变化如图所示。
(第22题图)
完成下列填空。
(1)室温下,测得0.1 mol·L-1H2C2O4溶液的pH=1.3,写出草酸的电离方程式:____________________________________________。
(2)向草酸溶液中滴加KOH溶液至pH=2.5时发生的主要反应的离子方程式是____________________________________________。
(3)继续加入KOH,调节pH由2.5直至大于6.5,调节过程中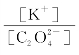 比值将_________(填“增大”“减小”或“不变”)。
比值将_________(填“增大”“减小”或“不变”)。
(4)工业上制取草酸的原理如下。
该反应的平衡常数表达式K=__________________________,下列能说明反应已经达到平衡的是_________(填编号)。
A.平衡常数K保持不变 B.反应液的pH保持不变
C.丁醇的浓度保持不变 D.反应液的总质量保持不变
23.(2020·闵行·二模)NaClO、NaNO2、Na2SO3等钠盐在多领域有着较广的应用。
完成下列填空。
(1)Na2SO3溶液中存在水解平衡:![]() 设计简单实验证明该平衡存在。
设计简单实验证明该平衡存在。
_______________________________________________________________________________。
(2)0.1mol·L-1Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)pH变化见下表。
(第23题表)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




