电解实验离不开外加电压、电极和电解质的水溶液,电解水时阴极和阳极所发生的反应为:
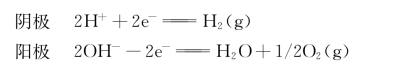
所以,水的电解实验要受电压的高低、电极电势和电解质溶液种类及浓度的影响。可以通过水电解时外加电压对电解液中离子电迁移率的影响、电极电势和电解液的酸碱性对氢气和氧气析出的影响,来分析该实验不成功的原因。
(1)外加电压和离子迁移率对水电解实验的影响
电解反应的进行以及反应速率,与电解质溶液中的离子迁移存在下列关系:

如果以r+和r-分别表示正、负离子的迁移速率,那么,在一定温度和浓度时,离子在外电场作用下的迁移速率与电位梯度成正比,可表示为
![]()
式中,比例常数U+、U-是电位梯度dE/dL=1V/m时的离子迁移速率,称为离子电迁移率(又称为离子淌度),单位是m2/(s·V)。
由(2)式可知,若电解时所用的电极及两极间距离不变,两电极间所施加的电压越大,离子的迁移速率就越大,也越容易得到气体。因此在电解时,要在短时间内产生较多量的气体,应施加一定强度的电压。由于电解含氧酸或碱的水溶液的理论分解电压为1.23V,因此,为了在短时间内观察到较多气体,应选择高于理论分解电压。本实验可以从4V开始,逐渐加大外加电压,寻找出适合课堂教学所需要的水电解电压。
从(2)式还可知,离子的迁移速率还和电迁移率有密切关系,在同样的电位梯度下,离子的电迁移率越大,则迁移速率越大,也就越容易得到气体。当溶液确定为无限稀的水溶液,温度确定为室温(298.15K)时,离子的电迁移率就只取决于离子的本性,具有确定的值。H+无限稀释时的电迁移率为36.2×10-8m2/(s·V),OH-无限稀释时的电迁移率为20.50×10-8m2/(s·V)。H+的电迁移率是OH-电迁移率的1.76倍。电解时,在相同条件下,H+比OH-的电迁移率大,H+离子就比OH-离子的迁移速率快,产生的氢气就比氧气的量多,这样氢气和氧气的体积比就大于2:1。
若水中H+离子和OH-离子的浓度很低,则正、负离子所传导的电荷量有限。由(1)式可知,电解水的反应速率很慢,短时间内就难以看到气体产生。所以,需要提高水中H+离子和OH-离子的浓度来增大正、负离子所传导的电荷量,加快氢气和氧气的析出速度。
(2)超电势对水电解的影响(https://www.xing528.com)
超电势是电解液中的离子在某一电流密度下,从电极上还原(或氧化)析出时的电势与可逆电势之间的差值,用η来表示,它们的关系如图3-3所示。
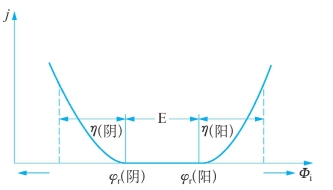
图3-3 电流密度与电极电势的关系
图中η(阴)、η(阳)分别为阴极和阳极的超电势;φr(阴)和φr(阳)分别为阴极和阳极的可逆电极电势,Φi为不可逆电极电势。可以看出,由于超电势的存在,正离子在阴极还原的电势比可逆电极电势更低,使H+的还原更困难;负离子在阳极上氧化的电势比可逆电极电势更高,增加了OH-氧化的难度。因而,超电势的存在,会导致阴、阳电极的电解反应步调不一致,也更容易出现析出气体的量与理论值的差异。
著名的塔菲尔公式η=a+bln(j/[j])表示了氢超电势与电流密度的定量关系。a、b是常数。a与电极材料、电极表面状态、溶液组成及实验温度等有关。b的数值对于大多数的金属来说相差不多。j是电流密度,[j]是j的单位。研究还发现,氧等气体析出时的超电势与电流密度的关系也有类似于塔菲尔公式的形式。可见,电解时,电极上超电势的大小与电流密度成正比关系。
所以,要得到课堂教学所需的结果,应该尽量减少超电势的影响,这样,电解时所施加的电压不是越大越好。选择合适的电极和电压(控制电流密度)至关重要。因为铂电极有降低超电势的作用,所以,本实验通常采用金属铂作为电极。
(3)电解液的酸碱性对水电解的影响
在电解中,阴极上析出电势越高的离子越容易获得电子而优先被还原;阳极上析出电势越低的离子越容易在阳极上放出电子而被氧化。不同酸碱度的电解质溶液对离子析出电势有不同程度的影响。
水电解两极反应的通式可表示为:氧化态+2e-→还原态。
离子析出的可逆电极电势为

式中,R、F为常数,T为溶液温度,z为电极反应中电子的计量系数。阴极反应中,H+是氧化态,H2是还原态;阳极反应中,O2是氧化态,OH-是还原态。当溶液中OH-浓度增大时,H+浓度减小,则可推导出H2在阴极的析出电势更低而不容易析出,而O2在阳极上的析出电势降低而更容易析出,促使两种气体析出速度相近,使VO2:VH2=2:1。所以,演示电解水实验时采用碱性电解液更有利于实验的成功。若采用酸性电解液,从上式可推出H2比O2更易析出,造成析出氢气的体积大于氧气体积的状况。此外,氢气和氧气在电解液中的溶解度是不同的。同温、同压下,氧气的溶解度比氢大,在浓NaOH溶液中差距小,且当NaOH溶液的浓度大于15%时,氢气和氧气的溶解量几乎相等。所以,用一定浓度的氢氧化钠溶液来进行电解水的实验,效果会更好。实验时,可以从5%的氢氧化钠浓度开始,逐步增大溶液浓度,探索出既能提供一定数量的H+离子和OH-离子,又能保证阴、阳离子迁移活度的最佳氢氧化钠溶液浓度。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




