由之前的分析可知,气态KOH的存在对CH4燃烧过程中基元反应具有一定的影响,通过消除火焰自由基,阻断链式反应达到抑制CH4火焰的作用。而气态KOH 消除自由基的反应路径可以通过对KOH 及KxOy类灭火活性物质的产率进行分析而得到。
图5.14为KOH的产率随时间的变化曲线。

图5.14 KOH产率随时间的变化曲线
从数据可以得出,体系中的链反应对KOH 是总体消耗的。KOH 消耗的主要反应是通过KOH + H →K + H2O(R29)分解产生K,其次是通过反应KOH+OH →KO+H2O(R34)消耗OH,生成KO。反应R29 产生的一部分K 通过K + OH →KOH(R27)生成少量KOH。在0.059 5 ms 左右KOH 消耗达到最大值,到约0.6 ms 时,KOH 的生成速率基本为0,所有反应的正逆反应之和达到平衡。通过此阶段的分析可知,反应R29 和R33 生成的K 和KO 参与到了火焰链式反应过程中。Friedman的研究表明,气态KOH 通过反应R27和R34 消除火焰自由基为放热反应,放热量分别为-36.6 kcal 和-13.7 kcal,说明反应R27 和R34 在火焰温度条件下可以很快激发活化能并进行反应,反应R27 的放热量大于R34,因此,消耗反应以R27 为主,与本研究的结论相一致。另外,由于产物K 和KO 通过R30 和R33 生成KOH 的反应为吸热反应,反应所需活化能较高,导致气态KOH 的再生效率不高,但由平衡计算可知,KOH 在平衡产物中的浓度较高,足以消除火焰中的O、H 和OH 自由基,达到了抑制火焰的目的。
图5.15为K的产率随时间变化曲线。

图5.15 K的产率随时间变化曲线
由图5.15 可知,体系中的K 自由基是净增的,K 自由基的增加主要通过反应KOH + H →K + H2O(R29)实现。虽然R25 与R27 也是消耗K 的反应,但消耗K 的量较少。由于碱金属抑制火焰的化学机理相似性,一些关于Na的火焰化学研究结论可以应用于K。Kaskan的研究结果表明,在贫燃料,且火焰温度范围为1 400~1 700 K 体系中,无法通过反应Na + H2O = NaOH +H 来解释在实验中观察到的Na 含量的减少,Kaskan 认为Na 含量的衰减速率与体系中O2的浓度有关,并且反应Na + O2 + M = NaO2 + M 为火焰中消耗Na 的主要反应,且NaO2为主要的Na 氧化产物。由CHEMKIN 的计算结果可知,反应R30的敏感性不及R25和R27,即通过R30进行反应的K 的量更少,说明在本研究条件下,反应R30并不是消耗K的主要反应,与Kaskan的研究结果基本一致。
Jensen 和Jones 的研究表明,Na 对于火焰的抑制作用是通过反应Na +H2O = NaOH + H 与Na + OH + M = NaOH + M 进行的,并且反应Na + OH +M= NaOH + M 的速率常数比Na + O2 + M = NaO2 + M 的大数倍,认为含Na物质对火焰的抑制作用体系中并没有NaO2的存在。
但是,Slack的研究表明,反应R27的速率常数k27 = 1.9×10- 25 cm6·mol- 2·s- 1小于Silver 研究得到的反应R25 的速率常数k25= 1.89×10- 22 cm6·mol- 2·s- 1,即反应R25 的发生优先于R27。从CHEMKIN 计算结果来看,对于K 单质,反应R25的产率大于R27,说明在本研究体系中,由于氧气充足,KO2为含K物质抑制火焰燃烧过程中的一个组分,与Slack的研究结论相一致。
图5.16、图5.17分别为KO和KO2自由基的产率随时间变化的曲线。

图5.16 KO自由基产率随时间变化的曲线

图5.17 KO2自由基产率随时间变化的曲线(https://www.xing528.com)
KO自由基产率呈现先增加后减少的趋势,但由于KO自由基增加的量大于减少的量,因此体系中的KO自由基可认为是净增加的。KO的净生成速率曲线与反应KO + H2O →KOH + OH(R33)的曲线基本重合,说明最初通过R34 生成KO 后,反应迅速由R34 转为R33,生成KOH。另外,还有少量的KO基是通过反应KO2 + H →KO + OH(R31)生成的。
由图5.17 可知,体系中KO2自由基是净减少的,并且净生成速率曲线与反应KO2 + H →KO + OH(R31)生成速率曲线基本重合,说明反应中大量的KO2 自由基是通过R31 消耗的,还有一小部分KO2 基通过反应K +O2 →KO2(R25)生成。
另外,Friedman的研究也表明,火焰链传播的重要自由基O、OH和H只有在有第三体M 存在的条件下才能与K 自由基发生反应。但由于两相反应发生所需的活化能远低于三相反应,即使K自由基与火焰自由基O、OH和H发生反应,在大气压力下,反应R27 速率比两相反应R29 和R34 低几个数量级。因此,Friedman 认为,由于竞争关系的存在,反应R27 不是消除火焰自由基的主要反应。
Heimerl 认为其他的含K 的中间产物,比如KH,在CH4的燃烧体系中也同样存在抑制作用,并且由于燃烧过程中涉及的化学反应众多并且中间产物复杂,模拟计算涉及各种不稳定中间化合物的热力学参数和动力学参数,因此,不可能对全部的中间产物进行分析和计算,应采用具有代表性的物质进行归类分析。本章在研究气态KOH抑制CH4燃烧反应的机理过程中,中间产物KO 与KO2代表一类K 的氧化物KxOy,对于另一类K 的氧化物K2O,由之前的热力学分析可知,K2O 的熔点较低并且生成KOH 的反应极易发生,因此,若钾盐添加剂在火焰温度下发生分解反应得到熔融态的K2O(l),会通过反应R35~R37 进一步形成气态KOH,本质上还是说明了钾盐添加剂在燃烧化学反应过程中产生的气态KOH为灭火过程中最重要的活性物质。
![]()
或
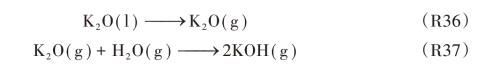
另外,Hynes提出的含Na的火焰化学模型包含了涉及Na、NaO、NaO2及NaOH 可能出现在火焰环境中的所有反应,提出在富氧的环境中可以不考虑NaH 的存在。并且Na 的浓度较低,在火焰环境中不会形成多于1 个Na 原子的物质。在本研究的Cup-burner 实验中,CH4与空气的比为1∶125,属于富氧燃烧,并且加入的钾盐添加剂浓度≤5%,因此,可以不考虑KH、K2O 及K2O2等中间产物的灭火作用。
Slack和Jensen认为含K物质火焰化学模型K →KO2 →KO →KOH →K及K →KOH →K 可以代表大部分含K 物质对火焰的抑制作用机理。而本书的研究表明,KOH为平衡产物中量最多的物质,含K物质对碳氢火焰的抑制作用应始于KOH。Hynes的研究也表明,在氧气充足的H2或碳氢火焰中,MOH(M 为碱金属)为主要的灭火活性物质,因此,综上所述,气态KOH 抑制熄灭扩散火焰的催化反应路径可以归纳为:

图5.18 为不同KOH 浓度条件下KOH、K 自由基、KO 自由基和KO2自由基各主要基元反应生成速率随时间变化曲线。

图5.18 不同KOH浓度条件下KOH、K、KO和KO2产率
(a)KOH;(b)K;(c)KO;(d)KO2
由图5.18 可知,当KOH 浓度增加时,曲线趋势基本不变,但曲线中增加或减小的幅度增大,说明增加的KOH 不会改变灭火的化学机理,仅使体系中KOH 自由基、K 自由基、KO 自由基和KO2自由基的数量增加,在燃料保持不变的条件下,更多的灭火活性物质参与到阻断火焰的链式反应过程中,在消除OH、H和O自由基而灭火的同时,循环再生灭火活性物质。
简单来说,化学灭火效能较高的钾盐添加剂抑制火焰的一般过程为:在水蒸气条件下,钾盐添加剂在火焰温度中很快生成KOH(g),与火焰自由基H 或OH 反应生成K 自由基和KO 自由基,这两种物质在火焰根部只能少量生成KOH,因为在钾盐添加剂作用下,此时的火焰根部已不是核心反应区。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




