【摘要】:动力电池在化学元件充放电状态所存储能量的方式与自由能ΔG不同。为了理解电池是怎样把化学能转化为电能的,首先应该理解铜和锌的化学反应:Cu2++Zn→Cu+Zn2+ (2-1)这是丹尼尔电池单体的基本反应,比罗伯特·戴维森的首次电池实验时间还要早。在这个冶金应用中,包含的化学能是不可利用的,很容易像热能一样消散掉。所以,在丹尼尔电池单体中,式(2-1)的反应是可以控制的,使化学能按照需要转化为有用的电能。
动力电池在化学元件充放电状态所存储能量的方式与自由能ΔG不同。为了理解电池是怎样把化学能转化为电能的,首先应该理解铜和锌的化学反应:
Cu2++Zn→Cu+Zn2+ (2-1)
这是丹尼尔电池单体的基本反应,比罗伯特·戴维森(Robert Davidson)的首次电池实验时间还要早。在式(2-1)的化学反应中,发生了氧化还原反应,铜离子被还原进而沉淀出来。实际上,式(2-1)的化学反应是从含有锌的矿石中提取出铜的应用。在这个冶金应用中,包含的化学能是不可利用的,很容易像热能一样消散掉。类似地,金属腐蚀就是一个带有负的自由能并且自发反应的电化学反应。
反应式(2-1)由两个电化学反应步骤组成,即
Cu2++2e-→Cu (2-2)(https://www.xing528.com)
Zn→Zn2++2e- (2-3)
在上面关于从电解液中提取铜的反应过程中,两个反应在新金属表面同时发生。然而,如果锌和铜是独立的两个元件,那么式(2-2)和式(2-3)的反应就必须在两个不同的位置(电极)发生,而且只有在有电流连接两个电极的情况下反应才能继续进行。并且,电子的流动在这个时候才是可以利用的。所以,在丹尼尔电池单体(见图2-10)中,式(2-1)的反应是可以控制的,使化学能按照需要转化为有用的电能。
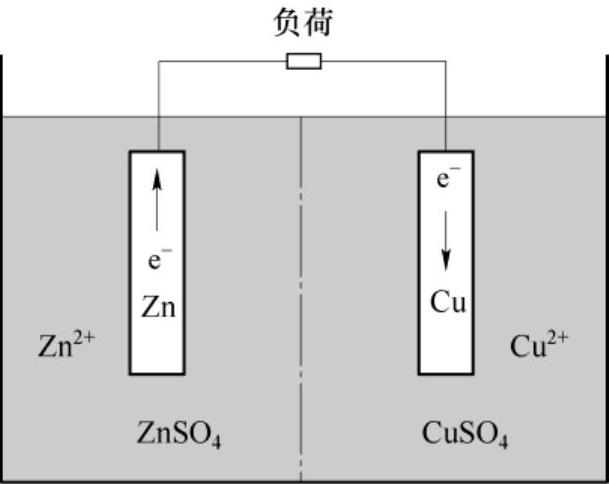
图2-10 丹尼尔电池单体
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




