1.等容过程 摩尔定容热容
在等容过程中,系统体积保持不变。等容过程的基本特点是体积V为常量,即dV=0。等容过程在p-V图上为一条平行于p轴的直线段,即等容线。
系统在准静态过程中状态参量之间的关系式叫作过程方程。理想气体在等容过程中,状态参量既要遵从状态方程![]() ,又受到过程特征V为常量的制约,故一定量理想气体等容过程的过程方程为
,又受到过程特征V为常量的制约,故一定量理想气体等容过程的过程方程为
如图9-3所示,理想气体经过等容过程,由于等容过程dV=0,所以系统做功dW=pdV=0。根据热力学第一定律,过程中的能量关系有
图9-3 等体过程
或
上面各式中的角标V表示体积不变,式(9-5)表明,在等容过程中,外界传给气体的热量全部用来增加气体的内能,系统对外界不做功。
为了计算在等容过程中气体吸收或放出的热量,我们引入摩尔定容热容的概念。
系统在某一无限小过程中吸收热量dQ与温度变化dT的比值称为系统在该过程的热容量,用符号C表示,即
它表示在该过程中,温度升高1 K时系统所吸收的热量,单位是J·K-1。其值由物质和过程决定,对于给定的系统(物质),进行的过程不同,其热容量也不同。若系统物质的量是1mol,则1mol物质的热容量叫摩尔热容(Cm),单位为J·mol-1·K-1。热容量与摩尔热容的关系为![]() ,式中m′为物质的质量,M为物质的摩尔质量。
,式中m′为物质的质量,M为物质的摩尔质量。
1 mol理想气体,在等容过程中吸收热量dQV与温度的变化dT之比为摩尔定容热容,即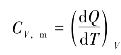 。由等容过程知dQV=dE,所以有
。由等容过程知dQV=dE,所以有
对于摩尔定容热容为CV,m,而物质的量为ν的理想气体,在等容过程中,其温度由T1改变为T2时,所吸收的热量为
式(9-7)亦可写成
由式(9-9)可以看出,对给定摩尔定容热容CV,m的1mol理想气体,其内能增量仅与温度的增量有关。因此,1mol给定的理想气体,无论它经历什么样的状态变化过程,只要温度的增量dT相同,其内能的增量dE就是一定的。也就是说,理想气体内能的改变只与起始和终了状态温度的改变有关,与状态变化的过程无关。
由式(9-9)可知,1mol理想气体的内能增量为CV,mdT,因此对于物质的量为ν的理想气体,在微小的等体过程中内能的增量为
已知理想气体的内能为
由此得
把它与式(9-10)相比较,可得
式(9-11)说明,理想气体的摩尔定容热容是一个只与分子的自由度有关的量,它与气体的温度无关。对于单原子理想气体分子,i=3,CV,m=![]() ;对于刚性双原子气体i=5,CV,m=
;对于刚性双原子气体i=5,CV,m=![]() ;对于刚性多原子气体i=6,CV,m=
;对于刚性多原子气体i=6,CV,m=![]() =3R。
=3R。
2.等压过程摩尔定压热容
在等压过程中,系统的压强保持不变。等压过程的特点是p为常量,即dp=0。等压过程在p-V图上是一条平行于V轴的直线,即等压线,如图9-4所示。理想气体等压过程的过程方程为
图9-4 等压过程
在等压过程中,向气体传递的热量为dQp,气体对外所做的功为pdV,所以热力学第一定律可写为
式(9-13)表明,在等压过程中,理想气体吸收的热量一部分用来增加气体的内能,另一部分使气体对外做功。
对有限的等压过程来说,向气体传递的热量为Qp,则有
得
根据理想气体的状态方程,可得出等压过程中系统对外所做的功为
等压过程中系统对外所做的功在数值上等于等压线下矩形的面积。
为了计算在等压过程中,气体吸收或放出的热量,我们也引入摩尔定压热容的概念。
设有1mol的理想气体,在等压过程中吸收热量dQp,温度升高dT,则气体的摩尔定压热容为
由上式可得在等压过程中,1mol理想气体的温度有微小增量时所吸收的热量为
故摩尔定压热容恒定而物质的量为ν的理想气体在等压过程中吸收的热量为
联立式(9-13)和式(9-15a),得
对于1mol的理想气体,因dE=CV,mdT,及定压过程pdV=RdT,所以有
式(9-16)叫迈耶公式,表示理想气体的摩尔定压热容比摩尔定容热容大一个恒量R。也就是说,在等压过程中,1mol理想气体的温度升高1K时,要比等容过程多吸收8.31 J的热量,用于对外做功。
系统的摩尔定压热容与摩尔定容热容之比,用γ表示,叫作比热容比,工程上称它为绝热指数,即
由于Cp,m>CV,m,所以γ>1。
对于理想气体,Cp,m=CV,m+R,且![]() ,所以有
,所以有
式(9-17)说明,理想气体的比热容比,只与分子的自由度有关,而与气体状态无关。根据式(9-17)不难算出:单原子气体的![]() ;刚性双原子气体的
;刚性双原子气体的![]() =1.40;刚性多原子气体的
=1.40;刚性多原子气体的![]()
3.等温过程(https://www.xing528.com)
系统温度保持不变的过程叫作等温过程,其特征是dT=0,即dE=0。等温过程的过程方程为
在p-V图上,等温过程可用双曲线的一支——等温线来表示,如图9-5所示。
图9-5 等温过程
因为在等温过程中,温度保持不变,而理想气体的内能是温度的单值函数,因此,在等温过程中,内能不变,内能的改变量等于零。即
为了得出等温过程中功的计算式,我们先找出此过程中压强p随体积V变化的关系。由气体状态方程可得
于是等温过程中功的计算式为
根据等温过程的过程方程p2V2=p1V1,上式还可以表示为
根据热力学第一定律及ΔE=0,可得在等温过程中吸收的热量为
式(9-19)表明,在等温过程中理想气体的温度虽然不变,但仍然要与外界交换热量。当理想气体等温膨胀时(V2>V1),系统吸收的热量全部用来对外做功;当等温压缩理想气体时(V2<V1),外界对气体所做的功全部转化为系统对外放出的热量。
4.绝热过程
系统不与外界交换热量的过程叫作绝热过程。由绝热材料包围的系统的变化过程,或时间极为短暂,系统来不及与外界交换热量的过程都可近似看成是绝热过程。绝热过程的特点是在任意微小过程中都有dQ=0,于是整个过程中热量Q=0。
当系统由温度T1经绝热过程变为温度T2时,内能的增量仍为
由于在绝热过程中Q=0,根据热力学第一定律可得
这就是说,绝热过程中系统内能的改变,完全取决于系统对外所做的功。当气体膨胀对外做功(W>0)时,其内能必然会减小(ΔE<0)。人们常用这一原理获得低温,即让气体绝热膨胀对外做功,使系统的温度下降。反之,当外界对系统做功时,气体内能就会增加,柴油机就是通过迅速压缩汽缸内的气体升高温度,使之达到柴油燃点而爆发做功。
在准静态绝热过程中,理想气体状态参量p、V、T不是独立的,它们之间的关系可由理想气体状态方程和热力学第一定律来求得。对于一个微小的绝热过程,热力学第一定律可表示为
将理想气体状态方程微分,可得
将上述两式联立,消去![]() dT,得
dT,得
因Cp,m=CV,m+R, ,则有
,则有
将上式两边积分,得
或
应用![]() 和式(9-21)分别消去p或V可得
和式(9-21)分别消去p或V可得
根据式(9-21),可在p-V图上画出绝热过程所对应的曲线,叫作绝热线。由于γ= ,因此过同一点的绝热线要比等温线陡一些,如图9-6所示。
,因此过同一点的绝热线要比等温线陡一些,如图9-6所示。
图9-6 绝热线比等温线陡
例9-1 有2mol氦气,由初始状态a(T1,V1)等压加热至体积增大1倍,再经绝热膨胀,使其温度降至初始温度,如图9-7所示。把氦气视为理想气体,试求:(1)整个过程氦气吸收的热量;(2)氦气所做的总功是多少。
图9-7 例9-1图
解 (1)根据状态方程有 ,即
,即
各过程吸收的热量为
整个过程吸收的热量
(2)对整个过程应用热力学第一定律,则
依题意,Ta=Tc,故ΔE=0,总功为
例9-2 1mol双原子分子理想气体的p-V关系如图9-8所示,由初态A(p1,V1)经准静态过程直线变到终态B(p2,V2)。试求该理想气体在A→B过程中:(1)内能增量;(2)对外界所做的功;(3)吸收的热量;(4)A→B过程的摩尔热容。
图9-8 例9-2图
解 (1)内能增量为
(2)A→B过程做的功为曲线下梯形的面积,故
因AB为过原点的直线,根据相似三角形有p1V2=p2V1,则
(3)由热力学第一定律,吸收的热量为
(4)根据状态方程,热量可写为
对于A→B过程中,任一微小状态变化均应有
由摩尔热容定义 得
得
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




