1mol可燃纯净物(单质或化合物)完全燃烧所需O2为Amol,则所需的空气量为4.76Amol。在实际的工作中,常把单位体积气体可燃物或单位质量的液体和固体可燃物完全燃烧所需的空气量称为单位空气量,简称空气量,用V空表示。可燃物如为气态,则其V空的单位常用m3/m3表示;如为液态或固态,则用m3/kg表示。
(一)气态纯净物
根据理想气体状态方程pV=nRT,在相同状态下,气体的摩尔比等于其体积比。由燃烧反应方程式可知,如果1mol气态纯净物完全燃烧需要Amol的O2,所需的空气量为4.76Amol,则1m3气态纯净物完全燃烧需要Am3的O2,所需的空气量为4.76Am3,即
V空=4.76A (2-6)
【例题2-1】试求1m3乙炔完全燃烧所需的空气量。
解: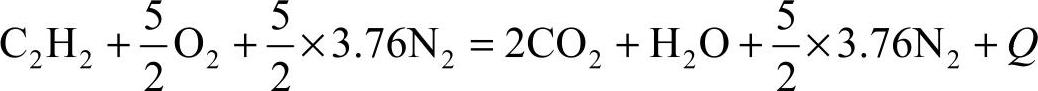
已知 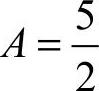
则 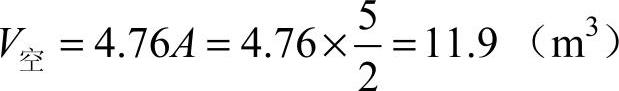
答:1m3乙炔完全燃烧所需的空气量为11.9m3。
(二)液态或固态纯净物
液态或固态纯净物,在标准状况下完全燃烧所需的空气量(m3/kg)可按下式计算
式中M——液态或固态可燃纯净物的摩尔质量(g/mol)。(https://www.xing528.com)
【例题2-2】试求1kg乙醇在标准状况下完全燃烧所需的空气量。
解:C2H5OH+3O2+3×3.76N2=2CO2+3H2O+3×3.76N2+Q
已知 A=3,M=46g/mol
则 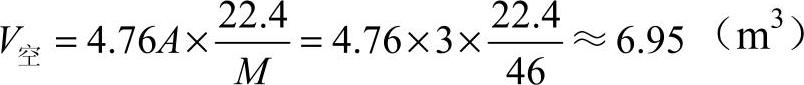
答:1kg乙醇在标准状况下完全燃烧所需的空气量为6.95m3。
若液态或固态纯净物在常温常压(25℃、1.01325×105Pa)下完全燃烧,则所需的空气量可按下式计算
那么,1kg乙醇在常温常压下完全燃烧所需的空气量(m3)为
若是在非标态下完全燃烧,则所需的空气量可根据理想气体状态方程pV=nRT进行计算。
【例题2-3】求1kg乙醇在20℃、0.9atm[1]条件下完全燃烧所需的空气量。解:根据乙醇的完全燃烧反应方程式可知,1mol乙醇需要3mol的O2,而1kg乙醇的物质的量为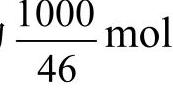 ,需要
,需要 的O2,则
的O2,则
答:1kg乙醇在20℃、0.9atm下完全燃烧所需空气量为8.30m3。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




