燃料电池的基本原理相当于电解反应的可逆反应。图9-2-1所示为燃料电池结构与电化学反应原理。氢气和氧气在燃料电池的负极和正极上借助催化剂的作用电离成离子,离子通过两电极中间的电解质在电极间迁移,进而在负电极、正电极间形成电压。在电极同外部负载构成回路时就可向外供电(发电)。
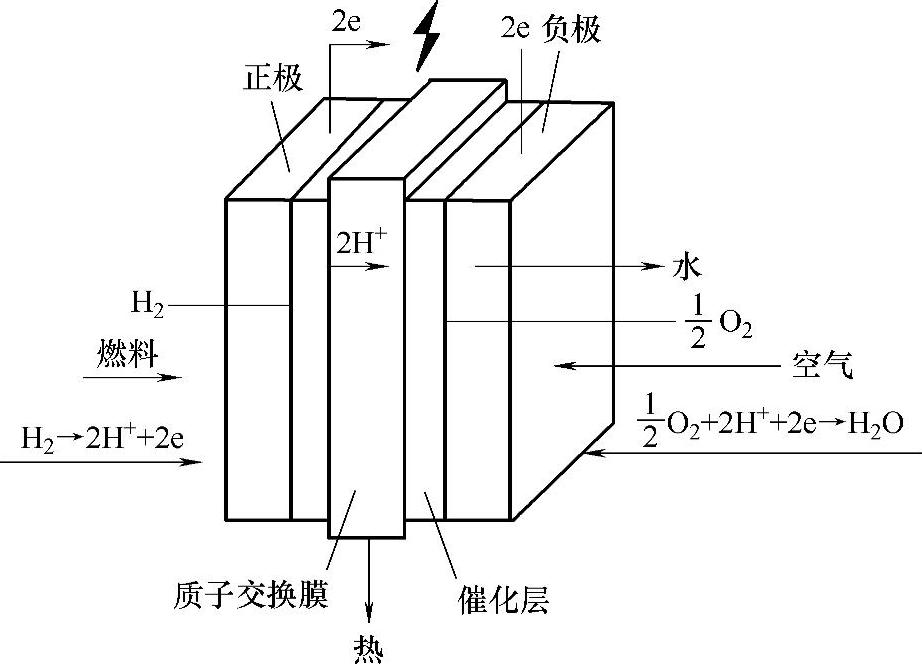
图9-2-1 燃料电池结构与电化学反应原理
燃料电池的电极通常做成平板,再附上一层薄电解质,如图9-2-2所示。电极结构通常是多孔的,这种多孔结构保证了两侧的电解质和气体可顺利通过,这样的结构使电极、电解质和气体之间有了最大程度的接触。
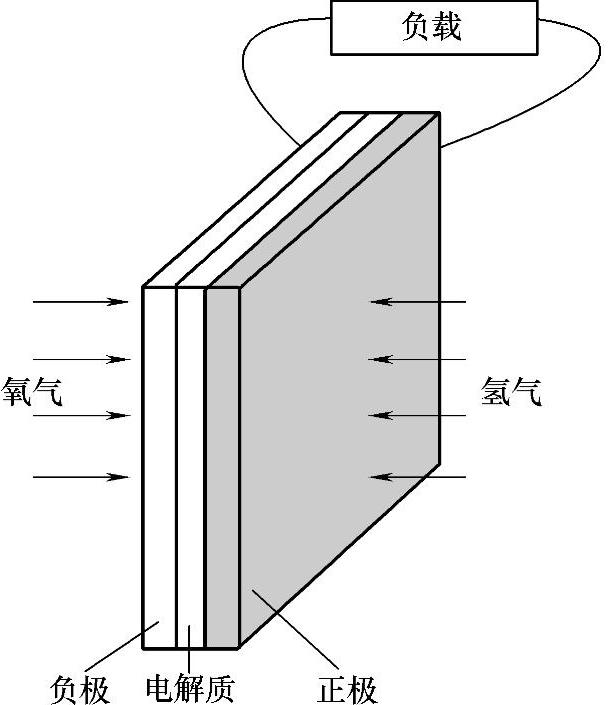
图9-2-2 燃料电池负极-电解质-正极的基本结构
燃料电池是一种原电池,借助于电化学过程,其内部燃料的化学能直接转换为电能。燃料和氧化剂持续且独立地供给燃料电池的两个电极,并在电极处进行反应。电解质的作用是辅助离子从一个电极传导至另一电极。(https://www.xing528.com)
燃料供给正极,依靠催化剂,电子从燃料中释放。在两电极间电位差的作用下,电子经外电路流向负极,正离子和氧结合,形成水。
燃料电池中的化学反应类似于蓄电池中的化学反应。燃料电池的热力学电压与反应中释放的能量和转移的电子数密切相关。原电池反应释放的能量由吉布斯自由能的变化量给出,通常以每摩尔克分子量表达。
理想情况下,燃料电池化学反应所释放出的最大电能量为反应过程中的吉布斯自由能变化量,燃料电池输出电压和吉布斯自由能存在一一对应关系。但在实际应用时,燃料电池的输出电压要低于上述对应值,且随工作状态的变化而变化,尤其是会随电流的增大而降低。造成燃料电池输出电压和理想状态存在较大差异的原因,是燃料电池在电化学反应过程中存在以下方面的能量损失,造成系统的不可逆性(又称极化现象):活性极化、燃料的穿透和内部短路电流、欧姆极化、浓差极化。这些现象的成因不尽相同,且在不同的工作条件下,各种极化现象对系统的影响程度也不同。4种极化现象的影响机理见表9-2-1。
表9-2-1 4种极化现象的影响机理

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




