1869年,俄国化学家门捷列夫将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行,制出来第一张元素周期表,揭示了化学元素间的内在联系,使其构成了一个完整的体系,成为化学发展史上的重要里程碑之一。
随着化学科学的不断发展,元素周期表中为未知元素留下的空位先后被填满,周期表的形式也变得更加完美。当原子结构的奥秘被发现后,元素周期表中元素的排序依据由相对原子质量改为原子的核电荷数,周期表也逐渐演变成我们常用的这种形式(如图1-1-1)。
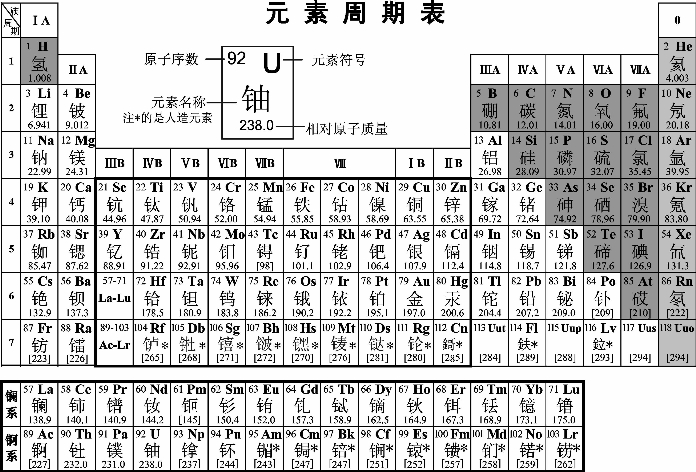
图1-1-1 元素周期表
按照元素在周期表中的顺序给元素编号,得到原子序数。在发现原子的组成及结构之后,人们发现,原子序数与元素的原子结构之间存在着如下关系:
原子序数=核电荷数=质子数=核外电子数
在周期表中,把电子层数目相同的元素,按原子序数递增的顺序从左到右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵行。(https://www.xing528.com)
元素周期表有7个横行,叫做周期。每一周期中元素的电子层数相同,从左到右原子序数递增,周期的序数就是该周期元素具有的电子层数。第一周期最短,只有两种元素,第二、三周期各有8种元素,称为短周期;其他周期均为长周期。
周期表有18个纵行。除8,9,10三个纵行叫做第Ⅷ族外,其余每个纵行各为一族。族有主族和副族之分。在周期表中,主族元素的族序数后标A,副族元素的族序数后标B。稀有气体元素原子最外层电子数为8(或2),化学性质不活泼,通常很难与其他物质发生化学反应,把他们的化合价定为0,因而叫做0族。
在周期表中有一些族的元素还有一些特别的名称。例如:
第ⅠA族(除氢):碱金属元素
第ⅦA族:卤族元素
0族:稀有气体元素
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




