1.溶度积常数
在一定温度下,把难溶强电解质AgCl 放入水中,则AgCl 固体表面的Ag+和Cl-因受到极性水分子的吸引,成为水合离子而进入溶液,这个过程称为溶解;同时,进入溶液的Ag+和Cl-由于不断运动,其中有些接触到AgCl 固体表面时,又会受固体表面正、负离子的吸引,重新析出回到固体表面上来,这个过程称为沉淀。当溶解和沉淀速率相等时,体系达到动态平衡,称为沉淀溶解平衡(此时溶液为饱和溶液),即
其平衡常数表达式为
其中: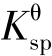 是难溶强电解质的沉淀溶解平衡常数,它反映了难溶强电解质的溶解能力,称为溶度积常数,简称溶度积。它表明在一定温度下,难溶强电解质的饱和溶液中,离子浓度方次的乘积是一个常数(浓度的方次等于相应离子的化学计量系数)。
是难溶强电解质的沉淀溶解平衡常数,它反映了难溶强电解质的溶解能力,称为溶度积常数,简称溶度积。它表明在一定温度下,难溶强电解质的饱和溶液中,离子浓度方次的乘积是一个常数(浓度的方次等于相应离子的化学计量系数)。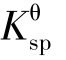 与其他化学平衡常数一样,只与难溶强电解质的本性和温度有关,与溶液中离子浓度的变化无关。
与其他化学平衡常数一样,只与难溶强电解质的本性和温度有关,与溶液中离子浓度的变化无关。
对于一般难溶强电解质BmAn来讲,在水中存在如下电离平衡(或称为沉淀-溶解平衡):
需要指出的是,只有在难溶电解质的饱和溶液中才会建立沉淀溶解平衡,其不饱和溶液和过饱和溶液中不存在沉淀溶解平衡;对于难溶电解质,无论其溶解度多么小,它的饱和溶液中总有达成沉淀溶解平衡的离子。任何沉淀反应,无论进行得多么完全,溶液中总还有沉淀物的组分离子,并且离子浓度方次的乘积等于其溶度积 。
。
2.溶度积与溶解度的关系
溶度积 从平衡常数角度描述难溶物溶解程度的大小,而溶解度S 是指一定温度、压力下,一定量饱和溶液中溶质的量。若溶解度S 的单位用mol·L-1,则与溶度积
从平衡常数角度描述难溶物溶解程度的大小,而溶解度S 是指一定温度、压力下,一定量饱和溶液中溶质的量。若溶解度S 的单位用mol·L-1,则与溶度积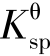 可直接进行换算。
可直接进行换算。
不同类型的难溶强电解质,其溶度积与溶解度之间的定量关系不同,现分类讨论如下:
(1)BA 型电解质,有
如BaSO4、AgCl、CuS、HgS、PbCrO4等。
(2)B2A(或BA2)型电解质,有
如PbI2、Ag2S、Ag2CrO4等。
(3)B3A(或BA3)型电解质,有
如Ag3PO4、Al(OH)3等。
(4)B3A2(或B2A3)型电解质,有
如Ca3(PO4)2、Sb2S3、Bi2S3等。
【例题4.15】298 K 时,BaSO4的溶解度S=2.4×10-4g/100 g H2O,求BaSO4的溶度积。已知BaSO4的摩尔质量为233 g·mol-1。
解:由于BaSO4的溶解度很小,因此将溶液的密度近似看作1 g·mL-1。BaSO4的摩尔溶解度可用体积摩尔浓度代替,近似为2.4×10-4×10/233=1.03×10-5mol·L-1,则
【例题4.16】 已知298.15 K 时,AgCl、AgBr 和Ag2CrO4的溶度积依次为1.8 ×10-10、5.2×10-13和9.0×10-12,分别求它们的溶解度,并比较它们的溶解度大小。
解:AgCl 的饱和溶液存在如下平衡:
平衡浓度/(mol·L-1): S1 S1
AgBr 的饱和溶液存在如下平衡:
平衡浓度/(mol·L-1): S2 S2
Ag2CrO4的饱和溶液存在如下平衡:(https://www.xing528.com)
平衡浓度/(mol·L-1): 2S3 S3
溶解度由大到小排列顺序依次为:Ag2CrO4、AgCl、AgBr。
从以上例题可看出:
(1)溶度积与溶解度可以用彼此之间的关系式进行相互换算;
(2)相同类型的难溶强电解质, 大的,溶解度也大;
大的,溶解度也大; 小的,溶解度也小。而不同类型的难溶强电解质就不能用
小的,溶解度也小。而不同类型的难溶强电解质就不能用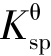 直接比较溶解度的大小,必须通过计算来判断。
直接比较溶解度的大小,必须通过计算来判断。
另外,在进行 与S 之间的相互换算时,应保证电解质电离出的离子仅仅以水合离子的形式存在,不能发生水解或其他反应。3.同离子效应和盐效应
与S 之间的相互换算时,应保证电解质电离出的离子仅仅以水合离子的形式存在,不能发生水解或其他反应。3.同离子效应和盐效应
难溶电解质的溶解度除与本身的溶度积、温度有关外,还受其他因素的影响。例如,在难溶电解质的饱和溶液中加入易溶强电解质,难溶电解质的溶解度会受到不同程度的影响,通常会产生两种效应,即同离子效应和盐效应。
1)同离子效应
在难溶电解质的饱和溶液中,加入与其含有相同离子的易溶强电解质,难溶电解质的沉淀溶解平衡将向生成沉淀的方向移动,导致难溶电解质的溶解度降低,这种现象称为同离子效应。同离子效应的定量影响可通过平衡关系计算确定。
【例题4.17】已知298 K 时BaSO4的 =1.08×10-10,计算BaSO4在浓度为0.010 mol·L-1的BaCl2溶液中的溶解度。
=1.08×10-10,计算BaSO4在浓度为0.010 mol·L-1的BaCl2溶液中的溶解度。
解:设BaSO4的溶解度为S,则有
由于Ksp很小,溶液中Ba2+主要来自BaCl2,所以
2)盐效应
在难溶电解质的饱和溶液中加入与其不含相同离子的易溶强电解质,将使难溶电解质的溶解度增大,这种现象称为盐效应。
产生盐效应的主要原因是溶液中带电荷的离子增多,阴、阳离子的浓度增大,静电作用增强,难溶强电解质的沉淀离子会被带相反电荷的易溶强电解质离子所包围,沉淀离子受到约束,相互碰撞或与沉淀表面碰撞的几率明显降低,使沉淀过程变慢,难溶电解质的溶解速度暂时超过沉淀速度,平衡向沉淀溶解的方向移动。当达到新的平衡时,难溶电解质的溶解度就会增大。
在进行沉淀反应时,同离子效应和盐效应有时会同时存在,盐效应对难溶物溶解度的影响与同离子效应相比要小得多,因此可忽略盐效应,只考虑同离子效应的影响。
4.溶度积规则
难溶电解质的沉淀溶解平衡是一种动态平衡,当溶液中难溶电解质离子浓度变化时,平衡就向一定方向移动,直至重新达到平衡。例如,当一定温度时,对于任意难溶电解质BmAn溶液来说,存在着如下关系式:
其反应商(又称难溶电解质的离子积)Qi可表示为
其中:Qi表示任意状态下难溶电解质离子浓度方次的乘积,它随着溶液中有关离子浓度的变化而不同。Qi与 表达形式相同,但两者的概念是完全不同的。
表达形式相同,但两者的概念是完全不同的。 是平衡状态下难溶强电解质离子浓度方次的乘积,在一定温度下,是一常数;而Qi是任意状态下难溶强电解质中各离子浓度方次的乘积,在一定温度下,其数值不定。换言之,
是平衡状态下难溶强电解质离子浓度方次的乘积,在一定温度下,是一常数;而Qi是任意状态下难溶强电解质中各离子浓度方次的乘积,在一定温度下,其数值不定。换言之, 仅仅是Qi的一个特例。
仅仅是Qi的一个特例。
在任何给定的溶液中,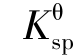 与Qi相比较可能有以下3 种情况:
与Qi相比较可能有以下3 种情况:
(1)Qi= ,溶液为饱和溶液,体系处于沉淀溶解平衡。
,溶液为饱和溶液,体系处于沉淀溶解平衡。
(2)Qi< ,溶液为不饱和溶液,无沉淀析出,若溶液中有固体存在,平衡向沉淀溶解的方向移动,直至达到平衡(饱和溶液)状态为止。
,溶液为不饱和溶液,无沉淀析出,若溶液中有固体存在,平衡向沉淀溶解的方向移动,直至达到平衡(饱和溶液)状态为止。
(3)Qi> ,溶液为过饱和溶液,平衡向生成沉淀的方向移动,溶液中有新的沉淀析出。这就是溶度积规则,应用此规则,可以判断沉淀的生成和溶解。
,溶液为过饱和溶液,平衡向生成沉淀的方向移动,溶液中有新的沉淀析出。这就是溶度积规则,应用此规则,可以判断沉淀的生成和溶解。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




