ds 区元素包括ⅠB 族的铜(Cu)、银(Ag)、金(Au)和ⅡB 族的锌(Zn)、镉(Cd)、汞(Hg),它们的价电子构型为(n-1)d10ns1~2。从最外电子层来看,ds 区元素与碱金属、碱土金属一样,都只有ns1~2价电子,容易形成+1 或+2 价化合物,但其性质却与碱金属、碱土金属并不相似,原因主要是次外层的电子数不同,ds 区元素次外层为18 个电子,碱金属、碱土金属次外层为8 个电子。ds 区元素原子的有效核电荷较多,而且18 电子构型对原子核的屏蔽效应比8 电子构型小得多,所以ds 区元素原子最外层的s 电子受核电荷的吸引比碱金属、碱土金属要强得多,因而相应的电离能高得多,原子半径小得多,密度大得多。
ⅠB 族、ⅡB 族元素同周期从左至右的原子半径不是减少而是略微增大。ds 区元素的熔点、沸点比d 区元素低,特别是ⅡB 族元素熔点、沸点都较低,而且从上到下呈递减的趋势。汞(Hg)的熔沸点分别为-38.84℃和357℃,是唯一在室温下呈液态的金属。由于汞在室温下蒸气压较大,所以必须储存在密闭容器中或加水密封保存,在使用中应该要特别小心,避免其挥发,被人体吸收而造成汞中毒,危害人体健康。ⅠB 族银、铜、金都是良好导电材料。
ⅠB 族元素在常温常压是不怕水、不怕酸、不怕氧化且很稳定的金属,其中Ag 和Au在自然界有单质存在,可以采集;而Cu 的冶炼发展较早,所以铜钱、银元、金元宝自古以来就是人们进行贸易的货币。现代各国所用的纸币,也都要有国家黄金储备赋予流通的价值,国际贸易以金作为交换的标准,所以ⅠB 族元素有货币金属之称。ⅡB 族元素相对来讲(尤其是Zn)比较活泼一些,它们化学性质则介于ⅠB 族和ⅡA 族之间。ⅠB 族和ⅡB族元素的金属活泼顺序为:Zn>Cd>H>Cu>Hg>Ag>Au。
ⅡB 族元素中,Zn、Cd 在化学性质上相近,Hg 和它们相差较大,在性质上类似于Cu、Ag、Au。ⅡB 族元素其氧化态主要为+2(汞有+1 价,即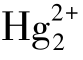 ),离子无色。而ⅠB 族中Cu、Ag、Au 都有不同的氧化态存在,但最常见的稳定氧化态Cu 为+2 价,如CuSO4、CuCl2等;Ag 为+1 价,如AgNO3、AgCl 等;Au 则为+3 价,如AuCl3、Au2O3等。(https://www.xing528.com)
),离子无色。而ⅠB 族中Cu、Ag、Au 都有不同的氧化态存在,但最常见的稳定氧化态Cu 为+2 价,如CuSO4、CuCl2等;Ag 为+1 价,如AgNO3、AgCl 等;Au 则为+3 价,如AuCl3、Au2O3等。(https://www.xing528.com)
ⅠB 族和ⅡB 族元素的化学活泼性随原子序数的增大而递减,这与碱金属、碱土金属的情况恰好相反。这种变化规律和它们标准电极电势数值的大小是一致的,也和它们从金属原子变成水合R2+离子所需总能量的大小是一致的。
ⅠB 族、ⅡB 族元素一般形成共价型化合物,而且其离子也容易形成配合物。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




