原子是由原子核与核外运动的电子所组成。每一个电子的运动状态可用主量子数n、角量子数l、磁量子数m和自旋量子数ms等四个量子数来描述。
由于核外电子之间存在着相互作用,其中包括电子轨道之间的相互作用,子自旋运动之间的相互作用以及轨道运动与自旋运动之间的相互作用等,因此原子的核外电子排布并不能准确度表征原子的能量状态,原子的能量状态用n、L、S、J等四个量子数为参数的光谱项来表征。以n2S+1LJ表示核外电子分布的层次,其中:
n为主量子数,取一系列整数,即n=1,2,3,…,n=1离核最近。
L为总角量子数,其数值为外层价电子角量子数l的矢量和![]() 。两个价电子偶合所得的总角量子数与单个价电子的角量子数l1、l2有如下关系:L=(l1+l2),(l1+l2-1),(l1+l2-2),…,|l1-l2|,取值为0,1,2,3,…。
。两个价电子偶合所得的总角量子数与单个价电子的角量子数l1、l2有如下关系:L=(l1+l2),(l1+l2-1),(l1+l2-2),…,|l1-l2|,取值为0,1,2,3,…。
S为总自旋量子数,多个价电子总自旋量子数是单个价电子自旋量子数ms的矢量和,其值可取0,±1/2,±1,±3/2,±2,…。
J为内量子数,是由于轨道运动与自旋运动的相互作用即轨道磁矩与自旋磁矩的相互影响而得出的,它是原子中各个价电子组合得到的总角量子数L与总自旋量子数S的矢量和,J=( L+S),(L+S-1),(L+S-2),…,|L-S|。若L≥S,则J值从J=L+S到L-S,有(2S+1)个值;若L<S,则J值从J=L+S到L-S,有(2L+1)个值。
由于原子中各电子之间存在着相互作用,整体原子的状态(能级)并不是各个电子状态的简单加和,除价电子外,原子核外的电子排布呈稳定状态,它们的总角动量和总磁矩都为零,所以光谱学上通常只考虑价电子的量子化能级;在考虑两个或多个电子同时被激发也有可能,但所需能量很大,一般不易观察到它们所形成的光谱。所以对整个原子体系而言,它的量子化能级要用主量子数n和另外三个量子数(总角量子数L、总自旋量子数S和总内量子数J)构成的光谱项n2S+1LJ来描述。由于L与S的共同作用在光谱中形成2S+1(或2L+1)条距离很近的谱线,光谱项符号L左上角的“2S+1”称为光谱项的多重性,J值不同的光谱项称为光谱支项。
现以钠离子为例说明如何根据原子结构导出原子基态光谱项以及由基态向第一激发态跃迁时光谱项的变化。
钠原子基态的电子结构是1s22s22p63s1。钠原子基态的能量状态由3s1光学电子决定,L=0,S=1/2;因为L<S,则J有(2L+1)个值,J只有一个取向,J=1/2,故钠原子基态只有一个光谱支项32L1/2。
钠原子第一激发态的光学电子是3p1,L=1,S=1/2,2S+1=2,J=1/2、3/2,故有32P1/2与32P3/2两个光谱支项。(https://www.xing528.com)
这说明钠原子基态价电子受到激发时有两种跃迁,其能量差分别为
ΔE=E(32P1/2)-E(32S1/2)=hν1=hc/λ1,
共振线波长为λ1=589.6nm;
ΔE=E(32P3/2)-E(32S1/2)=hν2=hc/λ2,
共振线波长为λ2=589.0nm。
把原子中所有可能状态的光谱项即能级和能级跃迁用图解的形式表示出了,称为能级图。图11-1是钠原子的部分原子能级图,其纵坐标表示原子能量水平E,用电子伏特(eV)表示,把基态原子的能量定为E=0,能级间的连线表示价电子在相应能级间跃迁的原子光谱线,横坐标是用光谱支线表示的原子实际所处的能级。
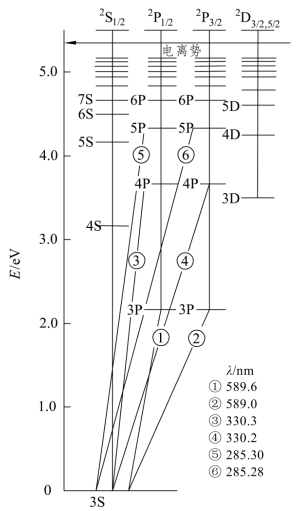
图11-1 钠原子的部分原子能级图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




