根据待测组分的电化学性质,选择合适的指示电极与参比电极,浸入试样溶液中组成原电池,测量原电池的电动势。然后根据Nernst方程式中电极电位(实际为电池电动势)与有关离子活度(或浓度)的关系,求出待测组分含量的方法,称为直接电位法。直接电位法的两个重要应用是利用pH玻璃电极测定溶液的pH以及利用离子选择电极测定溶液中阴、阳离子的浓度。下面分别予以介绍。
1.玻璃电极的结构与测量原理
(1)玻璃电极的结构
实验室最常用的一种玻璃电极的结构如图12-4所示。它是在一玻璃管的下端接一软质玻璃(组成为SiO2、Na2O和CaO)的球形薄膜(其厚度不到0.1mm),膜内盛一定浓度的KCl,pH为4或7的缓冲溶液,溶液中插入银-氯化银电极(称内参比电极)。因为玻璃电极的内阻很高(约100MΩ),故电极引出线及导线都要高度绝缘,并装有屏蔽隔离罩,以防漏电和静电干扰。
(2)测量原理
当玻璃电极的玻璃膜内、外表面与水溶液接触时,能吸收水分形成一厚度为10-5~10-4mm的溶胀水化层,即水化凝胶层。该层中的Na+(或其它一价离子)可与溶液中的H+进行交换,使膜内、外表面上Na+的点位几乎全被H+所占据。越深入凝胶层内部交换的数量越少,即点位上的H+越来越少,Na+越来越多,达到干玻璃层处全无交换,即全无H+。由于溶液中H+的活度与凝胶层中H+的活度不同,H+将由活度高的一方向低的一方扩散。
例如,H+由溶液向水化凝胶层方向扩散(阴离子和高价阳离子难以进出玻璃膜,故无扩散),余下过剩的阴离子,因而在两相界面间形成一双电层,产生电位差。双电层电位差抑制H+的继续扩散,当扩散达到动态平衡时,电位差达到一稳定值。这个电位差值即相界电位,如图12-5所示。

图12-4 玻璃电极
1—玻璃膜球;
2—缓冲溶液;
3—银-氯化银;
4—玻璃管;
5—静电隔离层;
6—电极内导线;
7—电极外导线及接头

图12-5 玻璃电极电位示意图
相界电位按式(12-4)遵守Nernst方程式,有

式中,V1,V2分别为外部溶液和内部溶液与相接触水化凝胶层之间的相界电位;K1,K2为与玻璃电极外表面及内表面性质有关的常数;a1,a2分别为外部溶液和内部溶液中H+的活度;![]() 分别为外部溶液和内部溶液接触的两个水化凝胶层中H+的活度。
分别为外部溶液和内部溶液接触的两个水化凝胶层中H+的活度。
可以看到,整个玻璃膜的电位Em是两个相界电位V1和V2之差,设V1>V2,则
![]()
只要玻璃膜内、外两个表面的物理性能相同,即两个表面上的Na+点位数相同,且已完成被H+所取代,K1=K2,![]() 。因此,膜电位为
。因此,膜电位为

因为a2是个固定值,式(12-7)可写为
![]()
式中,K′为常数。整个玻璃电极的电位φ为
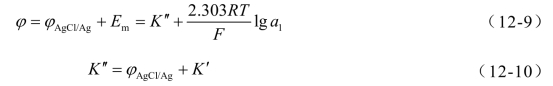
式中,φAgCl/Ag为Ag-AgCl内参比电极电位;K′为电极常数。
把待测溶液H+活度a(H+)代入式(12-9),得

式(12-11)表明,玻璃电极的电位与外部溶液H+活度的关系符合Nernst方程式,故用玻璃电极可测定外部溶液H+活度,即可测定溶液pH。
(3)测量方法
测量溶液pH(氢离子活度)的原电池可表示为:(-)玻璃电极|待测溶液ǁSCE(+)
根据式(12-3),上述电池电动势为
![]()
将式(12-11)代入式(12-12),得

式(12-14)表明,只要玻璃电极常数K′已知并固定不变,测得电动势Ex,便可求得待测溶液的pHx。实际上,由于K′常随不同电极,溶液组成不同,甚至随电极使用时间的长短而发生微小变动,其变动值又不易准确测定,故pH测量采用“两次测量法”。测量时,先用一pH已知的标准缓冲溶液与玻璃电极和SCE组成电池,仿照式(12-14)有以下关系式(https://www.xing528.com)

联立式(12-14)与式(12-15),经移项整理得
![]()
按“两次测量法”的公式(12-16)计算待测溶液的pHx,只需知道Ex和Es的测量值和标准溶液的pHs,无需知道K′的数据。因此可以消除由于K′不确定性产生的误差。
饱和甘汞电极在标准缓冲溶液和待测溶液中产生的液接电位未必相同,二者之差称为残余液接电位,其值不易测得,在准确的pH测量中可能引起误差。但只要两种溶液的pH极为接近,残余液接电位引起的误差可以忽略。因此,测量时选用的标准缓冲溶液的pHs要尽可能地与待测溶液的pHx接近。一些常用标准缓冲溶液的组成和它们在0~60℃温度区间内的pH,可查阅有关分析化学手册。
2.玻璃电极的性能
式(12-11)表明,溶液pH每改变一个单位,电极电位相应改变59.2mV(25℃),此值称为转换系数,以S表示,即
![]()
若作玻璃电极的φ-pH曲线,S为曲线的斜率,通常玻璃电极的S稍小于理论值(2mV/pH)。在使用过程中,由于玻璃电极逐渐老化,S与理论值的偏离越来越大,最后不能再用。
一般玻璃电极的φ-pH曲线,只在一定范围内呈直线,在较强的酸、碱溶液中,便偏离直线关系。在pH>9的溶液中,普通玻璃电极对Na+也有响应,因而求得的H+活度高于真实值,即pH读数低于真实值,产生负误差,这种误差称为碱差或钠差。若使用含Li2O的锂玻璃制成的玻璃电极,可测至pH=13.5也不产生误差。在pH<1的溶液中,普通玻璃电极测得的pH高于真实值,产生正误差,这种误差称为酸差。普通玻璃电极产生酸碱误差的性质图12-6所示。

图12-6 普通玻璃电极的酸碱误差
由于制作工艺等因素,玻璃膜内、外两个表面的性质并不能完全相同,它们吸水后形成水化凝胶层的H+交换性能也不完全相同。当膜两侧溶液pH相等时,两侧相界电位差值(膜电位Em)理应等于零。可是实际的Em并不为零,这个电位差称为不对称电位。不对称电位已包括在电极电位公式的常数项内,只要它维持恒定不变,pH测量便无影响。但是,在电极使用过程中,膜的外表面可能受到腐蚀、污染、脱水等作用,会使不对称电位变动而不维持稳定值。因此为避免产生误差,对玻璃电极的预处理、使用和保管均须严加注意。
温度过低,玻璃电极的内电阻增大;温度过高,电极的寿命缩短,所以一般玻璃电极最好在0~95℃温度范围内使用。
3.测量误差和注意事项
标准缓冲溶液的pHs,是通过下面的电池装置测定出来的。
Pt|H2||H+[a(H+)],Cl-[a(Cl-)]|AgCl(s)|Ag
其中pHs=-lga(H+),由于受a(Cl-)不确定性影响,标准缓冲溶液pHs的准确度只能达到±0.01pH单位。不过,只要测定仪器精度足够高,溶液和溶液之间相差0.002~0.001pH单位也可区别出来;对同一溶液的测定,重现性也可达0.002~0.001pH单位。因此,有的标准缓冲溶液pHs数值表小数点后给出3位数字。
由于标准缓冲溶液pHs准确度只能达到±0.01pH单位,残余液接电位通常也相当于±0.01pH单位,因此待测溶液的pHx的准确度也只能达到±0.01pH单位;两个溶液的pH最好只能区别到±0.004pH~±0.002pH单位。±0.02pH单位的测量误差,相当于4.5% a(H+)的误差(约为1.2mV);±0.004pH单位的测量误差,相当于1.0% a(H+)的误差[2]。
测定溶液pH时,应对玻璃电极和缓冲溶液两方面综合考虑,以达到测定值的准确。对玻璃电极,不可在有碱误差或酸误差的范围内测定,必要时可对测定结果加以校正;电极浸入溶液后必须有足够的平衡时间,一般在缓冲较好的溶液中几秒钟即可(搅拌下),在缓冲不好的溶液(如中和滴定临近终点时)常需数分钟;玻璃电极不用时,宜浸在蒸馏水中保存。对标准缓冲溶液,应选用其pHs与待测溶液的pHx尽量接近的,测定温度相同,以新配制为最佳,可保持2~3月。
如果以标准缓冲溶液校准玻璃电极,然后以此测定非水溶液的pH,所得的结果只能是非水溶液的“表观pH”,并没有准确的pH意义,因为两者并非相同的溶液体系,但用于指示非水溶液滴定的pH变化场合,仍然是可取的。
4.复合pH电极
用常规玻璃电极测定溶液pH需要另选一支参比电极,通常为饱和甘汞电极与之配对,组成测量电极,实际操作起来十分不便。将玻璃电极和参比电极组装起来,构成单一电极体,称为复合pH电极,其结构如图12-7所示。

图12-7 复合pH电极结构示意图
复合pH电极通常由两个同心玻璃套管构成,内管为玻璃电极,外管为参比电极。参比电极主件为Ag-AgCl电极元件或Hg-Hg2Cl2电极元件,下端为微孔隔离材料层,防止电极内、外溶液混合,又为测定时提供离子迁移通道,起到盐桥装置的作用。
把复合pH电极插入试样溶液中,就组成了一个完整的电池体系。只要把玻璃电极和参比电极元件的引线接到pH计接线柱上即可进行pH测定。使用复合pH电极省去了组装玻璃电极和饱和甘汞电极的麻烦,使用起来十分方便,特别有利于小体积溶液pH测定。
5.pH计和应用
pH计是专门为使用玻璃电极测定pH而设计的一种电子电位计,玻璃电极的内阻很高,测定由它组成的电池电动势时,只允许有微小的电流通过,否则会引起很大误差。例如,对内阻为100MΩ的玻璃电极,在测量中若有10-9A电流通过(一般灵敏检流计测量数量级),电池中将产生10-9A×108Ω=0.1V的电位降,这使测得的电位值比真实值小0.1V。以每pH单位相当于60mV计,就会产生1.6pH单位的误差。但是,当利用高输入阻抗的电子电位计时,测量通过的电流可小至10-12A以下。这样对内阻为100MΩ的电池所引起的电位降仅有10-12A×108Ω=0.0001V的电位降,只相当于产生0.002pH单位的误差,此误差对pH测量的影响可以忽略不计。
为使用方便起见,pH计内部安装电子线路,将电池输出的电动势直接转换成pH读数,目前使用的pH计均可直接显示mV/pH值,可选择显示两者数据。
pH计直接以pH读数显示,每一个pH单位相当于2.303RT/F(V),此值随测量电池中溶液温度的改变而改变,故pH计上装有温度调节器,调节它可使每一个pH单位的电动势改变值正好相当于测量温度时应有的变动值。pH计上还装有读数标度定位调节器,用标准缓冲溶液校准时,调节它使仪器显示的pH读数正好与标准缓冲溶液的pH相等。定位调节器的作用是在电池电动势时附加一适当电压,使pH读数与测定溶液的pH一致。pH计有多种型号,目前常用的有pH-25型、pHS-2型、pHS-3型、pHS-10型、pHS-300型等。这些pH计都装有毫伏(mV)/pH换挡键,因此它们又可作为电位计直接进行电池电动势的测量。
玻璃电极对H+很敏感,达到平衡快;可做得很小,能用于1滴溶液的pH测定;可连续测定,记录流动溶液的pH。因为它是由膜电位确定H+活度,电极时无电子交换,所以不受溶液中存在氧化还原剂的干扰,也可用于浑浊、黏稠、有色溶液的pH测定。玻璃电极和pH计在工农业生产、科学研究、医院卫生、遥控监测各方面都得到广泛应用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




