电位法除了测定氢离子的活度外,还可利用离子选择电极作为指示电极,广泛测定其它阴、阳离子的活度。虽然测量溶液pH的玻璃电极已有100多年的应用历史,但受电极膜理论不成熟与制造工艺的限制,直到20世纪60年代后期,其它离子选择电极从出现了迅速发展的势头,目前仍处于不断发展阶段,新电极、新技术不断涌现。至今已有五六十个主要品种的离子选择电极用于分析测定,其中包括对Na+、K+、Li+、![]() 及气体CO2、NH3、SO2等许多重要组分,或用其它方法不易测定组分的分析测定。离子选择电极也应用于理论研究工作,是电化学的一个新兴的重要分支。
及气体CO2、NH3、SO2等许多重要组分,或用其它方法不易测定组分的分析测定。离子选择电极也应用于理论研究工作,是电化学的一个新兴的重要分支。
1.离子选择电极的测量原理
离子选择电极是一种对溶液中特定离子(阴、阳离子)有选择性响应能力的电极。其电极电位与响应离子活度(或浓度)满足Nernst关系式,它们与一般电极体系不同,它的电极电位不是来源于交换电子的电极反应,而是来源于响应离子在电极膜上的离子交换和扩散作用。按1975年IUPAC建议的定义:离子选择电极是电化学的敏感体,它的电位与溶液特定离子的活度存在对数关系,这种装置不同于含氧化还原反应的体系。
应当指出,有些离子选择电极的膜电位不是通过简单的离子交换或扩散作用建立的,膜电位的建立还与离子的缔合、络合等作用有关;另有一些离子选择电极的作用原理,目前还不清楚。测量溶液pH的玻璃电极就是一种对氢离子有选择性响应的离子选择电极。因此,以上关于玻璃电极的基本构造、膜电位形成与特性、分析原理和测量方法,以及应用优越性等方面的讨论,原则上也适用于其它离子选择电极。
离子选择电极的结构构造包括电极膜、支持体(电极管)、内参比溶液和内参比电极四个部分,外接屏蔽导线,如图12-8所示。

图12-8 离子选择电极结构示意图
当把电极敏感膜浸入溶液时,膜内、外溶液中有选择性响应的离子,通过离子交换或扩散作用在膜内侧建立电位差,达到平衡后形成稳定的膜电位。因为电极内参比溶液中有关离子浓度恒定,内参比电极电位恒定。故离子选择电极电位就只与待测溶液中有关离子的活度(或浓度)有关,并满足Nernst关系式,即

式中,i为某选择性离子;K、K′分别为电极电位活度式和浓度式的电极常数;a为活度;f为活度系数;c为分析浓度;α为副反应系数;n为响应离子电荷。响应离子为阳离子时取“+”号,为阴离子时取“-”号。
2.离子选择电极的分类
根据1975年IUPAC推荐的离子选择电极的命名和分类,离子选择电极类型见表12-1。
表12-1 离子选择电极类型

(1)晶体电极 电极膜由导电性难溶盐晶体组成,是目前应用较多的一种离子选择电极。根据膜的组成和制备方法的不同,可分为均相膜电极和非均相膜电极。
均相膜电极 包括单晶膜电极与多晶压片膜电极。单晶膜电极的敏感膜由难溶盐的单晶切片制成。例如,将LaF3单晶(添加少量的EuF3以增加导电性)封在一塑料管的下端,管内充以浓度各为0.1mol/L的NaF和NaCl溶液作内参比溶液,插入Ag-AgCl电极作内参比电极,便构成F-选择电极。此外,用AgCl、Ag2S的单晶切片制成了测定Cl-、S2-、Ag+的单晶膜电极。
多晶压片膜电极的敏感膜是由一种多晶粉末添加Ag2S粉末(增加导电性)混匀压片制成。例如,单独用Ag2S的晶形沉淀,经粉碎、高压制成薄片作为敏感膜,用此膜制得的多晶压片膜电极可以测定Ag+和S2-。用卤化银添加Ag2S的多晶压片膜制成了测定Ag+、Cl-、Br-和I-的多晶压片膜。
非均相膜电极 其电极敏感膜是将难溶盐多晶微粒均匀分散到一种憎水性材料(如硅橡胶、塑料和石蜡等)中,经热压后制成。
(2)非晶体电极 电极的电极膜由非晶体材料组成,根据电活性物质性质的不同,可分为刚性基质电极和流动载体电极。
刚性基质电极 包括各种玻璃膜电极。此类电极对金属离子选择性响应的特性取决于玻璃膜的化学组成。改变吹制玻璃膜的玻璃组成配方,可以制得对出H+以外离子具有选择性响应的玻璃电极。例如,用化学组成为11%Na2O、18% Al2O3和71% SO2的玻璃吹制玻璃膜,制成Na+的玻璃电极。此外,还有Li+、K+和![]() 等玻璃膜离子选择电极。
等玻璃膜离子选择电极。
流动载体电极 又称液膜电极。其电极敏感膜的特点,是将与响应离子有作用的一种载体(络合剂或缔合剂)溶于和水不混溶的有机溶剂中,组成一种离子交换剂。将该交换剂吸入(或吸附)到一种微孔物质(如纤维素、醋酸纤维素、聚氯乙烯等)膜中,以此类膜制成的敏感膜。活性载体可以在膜内流动,但不能离开电极膜,故称为流动载体电极,其结构如图12-9所示。根据活性载体的带电性质,又进一步分为带电荷的流动载体电极和中性流动载体电极。带电荷的流动载体电极的活性载体为带电荷的阴、阳离子。
在液膜中采用中性载体是液膜电极的一个重要进展。中性载体是一种电中性的有机大分子,在此类分子中具有中心空腔的紧密结合结构,只对具有适当电荷和离子半径(大小与空腔适合)的离子进行络合,络合物能溶于有机相,构成液膜,形成待测离子相迁移的通道。选择适当的载体可使电极具有很高的选择性。钾离子选择电极是由K+的中性载体缬氨酸酶素制成的,缬氨素酶是一个具有三十六元环的环状缩酯酞,分子中6个羧基与K+络合而成1∶1的络合物。将其溶于有机溶剂(如二苯醚、硝基苯)中,可制成对K+有选择性响应的液膜,能在104倍Na+存在下测定K+。常用的有机大分子化合物除缬氨霉素外,还有放线菌素和冠醚(巨环醚)等。例如,钠离子选择电极就是由冠醚化合物(四甲基苯基-24-冠醚-8)作为中性载体而制成的,常用的有机溶剂有硝基苯、氯苯、溴苯等。已制成的中性流动载体电极有Li+、Na+、K+、Ca2+、Sr2+和![]() 等离子选择电极。
等离子选择电极。
将活性载体与增塑剂、聚氯乙烯(PVC)一起溶于四氢呋喃或环丙酮溶剂中,待溶剂挥发后即形成活性载体均匀分布在PVC支持体中的薄膜。将该薄膜制成电极,称为PVC膜电极。或在铂丝上涂一层含有活性载体的PVC薄膜,可制成PVC涂丝膜电极。这两种膜电极在药物分析中有着重要作用。
(3)气敏电极 是20世纪60~70年代发展起来的一种新型离子选择电极,具有对某些气体敏感的性能,是将离子选择电极与另一种特殊的膜组成的复合电极。常用的气敏电极包括对NH3、CO2、SO2、NO2、H2S等气体敏化的电极。
气敏电极的结构与上述离子选择电极有所不同,是将离子选择电极与参比电极组装成一复合电极。该电极由透气膜、内电解液、指示电极及参比电极等部分组成,电极本身就是一个完整的电池装置,其结构如图12-10所示。待测气体通过透气膜进入内充溶液发生化学反应,产生指示电极响应的离子或使指示电极响应离子的浓度发生变化,通过电极电位变化反映待测气体的浓度。
(4)酶电极 是在离子选择电极表面覆盖一层酶活性物质,被测物与酶反应可生成一种能被指示电极响应的物质。图12-11是尿素酶电极的示意图。

图12-9 流动载体电极示意图

图12-10 气敏电极示意图

图12-11 尿素酶电极示意图
研制酶电极的关键是寻找一种合适的酶反应,该反应有确定的产物,此产物可以用一种离子选择电极测量。例如,将尿素酶固定在凝胶内,涂布在![]() 玻璃电极的敏感膜上,便构成了尿素酶电极。当把电极插入含有尿素的溶液中时,尿素经扩散作用进入酶层,受酶催化水解生成
玻璃电极的敏感膜上,便构成了尿素酶电极。当把电极插入含有尿素的溶液中时,尿素经扩散作用进入酶层,受酶催化水解生成![]() ,即
,即
![]()
![]() 可以被
可以被![]() 玻璃电极响应,引起电极电位的变化,电位值在一定浓度范围内与尿素的浓度符合Nernst关系式。
玻璃电极响应,引起电极电位的变化,电位值在一定浓度范围内与尿素的浓度符合Nernst关系式。
由于酶的种类繁多,酶反应的专一性强,膜电极的选择性高,故膜电极是一种极有发展前途的离子选择电极,特别在生物、生理、医药、卫生等学科上具有重要的应用前景。除了尿素酶电极外,还制成氨基酸氧化酶、葡萄糖氧化酶、β-偏喉腺酶等酶电极。
3.离子选择电极的性能参数
(1)Nernst响应线性范围
根据式(12-18),离子选择电极电位与响应离子活度(浓度)的对数有线性关系。实际上,一支离子选择电极的电位只在一定的浓度范围内才有这种严格的线性关系。具有这种线性关系的浓度范围称为Nernst响应线性范围。电极的线性范围通常为10-6~10-1mol/L。使用时,待测离子浓度应在电极的Nernst响应范围内。在实际测量时,有些电极电位虽然与响应离子浓度有Nernst线性关系,但直线斜率与理论值并不一致,一般略低于理论值。
(2)选择性
理想的离子选择电极只对一种离子产生电极响应。但实际上,除待测离子外,电极敏感膜也可能对其它离子发生不同离子的响应。例如,pH玻璃电极除响应H+外,对Na+也有某种程度的响应,这种响应就造成玻璃电极钠差的原因。
如果以X和Y代表选择响应离子和干扰响应离子,nX和nY代表其电荷,aX和aY代表其活度,考虑到Y离子的干扰响应作用,时(12-18)应改为

式中,KX,Y称为电位选择性系数,可理解为在相同条件下,同一电极对X和Y离子响应能力之比,也即提供相同电位响应的X和Y离子的活度比,表示为

KX,Y越小,电极对X离子响应的选择性越高,Y离子的干扰作用越小。例如,一支玻璃电极的KH,Na=10-11,意味着该电极对H+的响应比Na+高1011倍。电位选择性系数的数值与测求KX,Y时采用的干扰离子浓度和实际条件有关,其数据仅供选用电极的参考,不宜用作定量校正。通常买到的离子选择电极附有干扰离子的电位选择性系数的数据。
(3)稳定性
电极电位在同一溶液中随时间发生的变动称为漂移。漂移值用以代表电极的稳定性,通常以8h或24h变动的电压(单位:mV)表示。电极稳定性与膜物质在水中的溶解度有关,也与电极结构和绝缘性能的好坏有关。液膜电极一般比晶体膜电极的稳定性好。
(4)检测限(https://www.xing528.com)
离子选择电极有效的检测下限与膜物质的性质有关。例如,晶体膜电极的检测限不可能低于难溶盐晶体溶解平衡给出的离子浓度。
(5)有效pH范围
离子选择电极有一定的有效pH使用范围。其值与电极膜对离子的响应机理有关,超出有效pH使用范围,将产生严重误差。
(6)响应速度
电极浸入测量溶液中达到稳定电极电位所需的时间称为响应速度,也称响应时间。响应速度一般为数秒到几分钟。溶液越稀响应时间越长。这一特性在测定响应离子浓度接近检测限的溶液时要特别注意。
此外,离子选择电极特性还包括电极内阻、不对称电位、温度系数和使用寿命等。
4.测量方法
使用离子选择电极测定溶液中阴、阳离子浓度,与使用pH玻璃电极测定溶液pH的原理和方法是类似的。即以待测离子的选择电极为指示电极,与一合适的参比电极(通常为SCE)和待测溶液组成原电池。通过对电池电动势的测量,然后换算得到待测组分的含量。电动势的测量可用兼有毫伏计功能的pH计,数字显示毫伏计或专用的离子计。
在一般的分析测试中,是利用式(12-18)的浓度式直接得到待测组分的分析浓度。为保持式(12-19)中的电极常数K′不变,则要求被测组分(响应离子)在试样溶液和标准溶液中应具有相同的活度系数fi和副反应系数αi。为做到这一点,视试样性质不同可采用两种方法。若试样基质(待测组分以外的主要成分)组成基本固定并已知,用这种试样制成溶液,待测组分有相同的电极常数。遇此情况,可选用与样品基质相同的标准样,或配制人工合成基质来制备测量用的标准溶液;若试样基质组成复杂,变动性大,为维持测量溶液的电极常数不变,可向试样溶液和标准溶液中,同时加入一种含有需要的pH缓冲剂、辅助络合剂和高浓度惰性电解质的溶液,用以维持溶液具有相同的活度系数和副反应系数。该混合溶液称为“总离子强度调节缓冲剂”。例如,用F-选择电极测定天然水的氟含量,可用HAc-KAc-KCl-EDTA或HAc-KAc-KCl-柠檬酸钾溶液体系作为TISAB。测量方法介绍如下。
(1)两次测量法
其原理与用玻璃电极测量溶液pH的原理相似。由饱和甘汞电极(SCE),离子选择电极和待测溶液组成电池,其电动势根据式(12-3)可表示为
![]()
将式(12-18)代入式(12-22),得
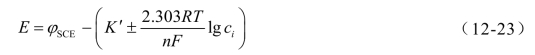
将φSCE与K′合并,用一新常数K表示,式(12-23)变为

若测量标准溶液cs和待测溶液cx的电动势分别为Es和Ex,将其代入式(12-24)相减,得

把Es的数值代入式(12-25)(阳离子取负号,阴离子取正号),求得cx值。此法是通过样品溶液与标准溶液进行对照测量完成的,又称为“标准对照测量法”。虽然操作步骤简单,但要求电极响应严格符合Nernst关系,且Ex-Es差值不能太小,否则产生较大误差。
(2)标准曲线法
标准曲线法是仪器分析常用方法之一。测量时,先配制3~5个浓度不同的标准溶液(基质应与样品相同),测量标准溶液的电动势。以标准溶液测得的Es对lgcs作图,通常可得一条直线,称为标准曲线。再在相同条件下测量样品溶液的Ex值,将其投影到标准曲线上,便可求出标准溶液中待测离子的浓度cx,如图12-12所示。

图12-12 标准曲线法示意图
标准曲线法的优点在于即使电极响应不符合Nernst关系式,也可得到满意的结果。
(3)标准加入法
在试样基质组成复杂,变动性大,或没有基质相同的标准样或人工合成基质以资利用时,宜采用标准加入法,测量原理如下。
设浓度为c0,体积为V0的样品溶液,测得电动势E0,按式(12-24)表示为
![]()
然后,向上述样品溶液中加入小体积Vs(比V0小数十倍)、高浓度cs(比c0大数十倍)的标准溶液,混匀。此时溶液中待测离子浓度为

因为加入小体积标准溶液后,溶液的基质几乎无变化,故电极常数不变,其电动势改变为

式(12-28)与式(12-26)相减,令

即得

改为指数表达式

移项,整理得

式中,c0、Vs和V0有确定的已知值;S值由式(12-29)给出。
把根据E1和E0测量值得到的ΔE值代入(12-31),便可求得样品溶液的待测浓度c0。
标准加入法的优点在于不需要配制标准系列溶液和绘制标准曲线;不必配制与添加总离子强度调节缓冲剂;操作简单、快速。适用于基质组成复杂、变动性大的一类样品的测定。
5.测量的准确度
在应用离子选择电极的电位法测量中,由于离子选择电极电位的不稳定性、选用参比电极电位和电池液接电位的不确定性,以及电极响应速度和温度的波动性等诸多因素的影响,使得对电动势(或电位)的测量最好只能准确到±1mV。利用对式(12-24)求微分,可以得到分析结果的相对误差与电动势测量误差的关系式

式中,电动势的计量单位为V(伏)。
式(12-32)表明,对1价离子,±1mV的测量误差,将产生±4%的相对误差;对2、3价离子,产生的相对误差分别是±8%、±12%。故直接电位法的测量误差比较大。该式还表明,分析结果的相对误差与待测响应离子浓度的高低无关,仅取决于电动势测量误差ΔE的大小,即稀溶液和浓溶液具有相同的测量精密度。因此,直接电位法用于低浓度组分溶液(10-6~10-5mol/L)的分析比较合适,因为这类测定对分析结果的准确度要求较低。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




