1.化学反应对吸收的影响
在化学吸收过程中,溶质A先从气相主体扩散到气液界面,其扩散机理与物理吸收时并无区别,气相吸收系数并不受影响。溶质A达到界面后便开始与溶剂中的反应组分B进行化学反应,B不断从液相主体扩散到界面或界面附近并与A相遇。A与B在什么位置进行反应取决于反应速率与扩散速率的相对大小。反应进行得愈快,A消耗得愈快,则A抵达气液界面后不用再扩散很远便会消耗干净。反之,A也可能扩散到液相主体中仍有大部分未能参加反应,因此,化学吸收的液相吸收系数不仅取决于液相的物理性质与流动状态,还取决于化学反应速率。
吸收操作中的化学反应有许多种。这里选取双分子反应(A+B→AB),定性地考查化学反应速率对液相吸收系数,即对吸收速率的影响。如图5-8所示,(a)、(b)、(c)、(d)各图的纵坐标表示液相内A的浓度与B的浓度;横坐标表示液相内各点距相界面的距离,zL为液膜的厚度。
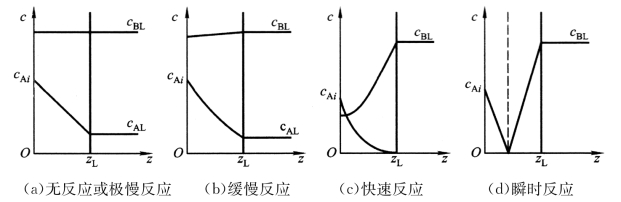
图5-8 双分子反应中相界面附近液相内A与B的浓度分布
图5-8(a)中A与B无化学反应。A的浓度从界面上的cAi线性降到液膜内侧的cAL,(cAi-cAL)是A在液相内扩散的推动力。B的浓度没有变化,在各处都等于cBL。这种情况属于物理吸收。若A与B的反应进行得极其缓慢,A与B的浓度基本上都不因反应而有所变化。用水吸收SO2或CO2是有水解反应的吸收,但反应进行得极慢,因此可按物理吸收来处理。
图5-8(b)中A与B进行缓慢反应。A与B的量都会因反应而稍微减少,反应主要在液相主体内进行,A与B在液膜内进行反应的部分所占比例很小。于是液膜内A的浓度变化为稍向下凹的曲线,B也由于反应而消耗了一些,它的浓度在靠近界面处稍有下降,所维持的浓度差使B不断从液相主体向界面扩散。此时吸收速率主要由反应速率所控制。另外,由于溶剂中溶有参与反应的物质B,黏度变大,A的扩散系数会变小,液相吸收系数往往反而比物理吸收时还小;但化学反应消耗了一部分A,加大了A的溶解度,使吸收推动力增大,总结果使吸收速率有可能增大。用Na2CO3溶液吸收CO2就属于有缓慢反应的化学吸收过程。
图5-8(c)中A与B为快速反应。A没扩散到液相主体之前便消耗殆尽,也就是反应完全在液膜内进行。液膜内A的浓度变化曲线也是向下凹的曲线,但曲率较大,在到达液膜内侧之前其浓度便降到零。液膜内B的浓度变化梯度则与A浓度变化梯度相对应。若cBL比cAi大,则B在界面上的浓度并不降到零。这种情况下的吸收速率由扩散速率与反应速率两者控制,吸收速率与液相吸收系数都比物理吸收大。属于快速反应的化学吸收,如用NaOH溶液吸收CO2,用发烟硫酸吸收SO3。
图5-8(d)中A与B为瞬时反应。若A与B的反应速率极快,二者刚一接触反应便进行完毕,则称为瞬时反应。这种情况下液膜内任意位置上A与B的浓度同时降为零,二者进行反应的位置称为反应面,它与气液界面平行(图d中的虚线)。反应速率愈大,或cBL大于cAi愈多,反应面愈靠近气液界面。极端情况是反应面与气液界面重合,表示A刚从气相主体扩散到界面便立刻因反应而消耗干净。A与B在反应面相遇之前,各自在液膜内扩散时都并无消耗,故其浓度变化都成直线。进行瞬时反应的化学吸收,吸收速率由A扩散到反应面的速率所控制。从A的扩散来看,由于扩散距离缩短,推动力增大,故液相吸收系数与吸收速率都大为增加,在反应面与气液界面相重合的极端情况下,液膜阻力降为零,吸收速率只决定于A从气相主体扩散到气液界面的阻力,成为气膜控制。用稀酸吸收NH3、碱液吸收SO2、NaOH溶液吸收HCl等都属于进行瞬时反应的化学吸收。
2.化学吸收的气液平衡
亨利定律只适用于常压或低压下的稀溶液,而且吸收质(被吸收组分)在气相与溶剂中的分子状态应相同,若被溶解的气体分子在溶液中发生化学反应,则此时亨利定律只适用于溶液中未发生化学反应的那部分吸收质的浓度,而该浓度决定于液相化学反应的平衡条件。
气体溶于液体中,若发生化学反应,则被吸收组分的气液平衡关系既应服从相平衡关系,又应服从化学平衡关系。溶于液相的溶质量为气相浓度物理平衡时的溶质量和由于化学反应消耗量之和。即
cA=[A]物理平衡+[A]化学消耗
设被吸收组分A与溶液中所含的组分B发生相互反应
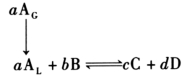
在被吸收组分浓度及各反应组分浓度较低的情况下有下列关系式
亨利定律关系式
![]()
化学平衡关系式
 (https://www.xing528.com)
(https://www.xing528.com)
式(5-24)可变为

得
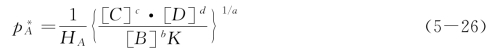
若已知系统中各组分的初始浓度,则按上述公式可计算出气体组分的总浓度cA。
3.伴有化学反应的吸收速率
在化学反应吸收过程中,被吸收气体组分与吸收剂或吸收剂中活性组分发生化学反应,从而降低了被吸收气体组分在液相中的游离浓度,相应增大了传质推动力和吸收系数,从而加快了吸收过程的速率。单位接触表面积的气液间化学反应吸收速率为
![]()
式中,K1——未发生化学反应时液相传质分系数,亦即物理吸收的液相分吸收系数,m/h;
β——由于化学反应使吸收速率增强的系数,简称增强系数;
cAi——气液界面处未反应的溶质浓度,kmol/m3;
cAL——在液相中未反应的溶质浓度,kmol/m3。
cAL值通常由假定液相中达到化学平衡条件下求出,反应为不可逆反应时,即化学平衡常数K为∞时,cAL=0。
4.SO2的化学吸收计算
在化学吸收中,有必要考虑溶解的SO2化学状态来计算其平衡蒸汽压和吸收中的气相推动力。令
G1——入塔气体的总摩尔流量,kmol/(m2·h);
y1、y2——入塔、出塔气体的SO2摩尔分数;
pH1——浆液的初始pH;
W——单位时间通过塔任一截面单位面积的吸收剂体积流量,m3/(m2·h)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




