知识链接
自来水处理过程中,一般采用氯气杀灭水中的微生物和细菌,以提高饮用水的安全性。但是氯对细菌细胞杀灭效果好,同样,对其他生物体细胞、人体细胞也有严重影响。添加氯,作为一种有效的杀菌消毒手段,目前仍被世界上超过 80%的水厂使用。所以,市政自来水中必须保持一定量的余氯,以确保饮用水的微生物指标安全。但是,当氯和有机酸反应,就会产生许多致癌的副产物,比如三氯甲烷等。超过一定量的氯,会对人体产生许多危害,且带有难闻的气味,俗称“漂白粉味”。所以自来水中氯离子的测定对人体健康有重要意义,必须检测自来水中氯离子的含量以及余氯的含量。
测定水中氯离子含量常用的方法是沉淀滴定法。沉淀滴定法也称容量分析法,是一种以沉淀反应为基础的滴定分析方法。
用作沉淀滴定的沉淀反应必须满足以下条件:
(1)反应速度快,生成沉淀的溶解度小;
(2)反应按一定的化学式定量进行;
(3)有准确确定理论终点的方法。
应用范围:含量在1%以上的卤素化合物和硫氰化物的测定。
沉淀反应很多,但能用于沉淀滴定的沉淀反应并不多,因为很多沉淀的组成不恒定,或溶解度较大,或形成过饱和溶液,或达到平衡速度慢,或共沉淀现象严重等。目前比较有实际意义的是生成微溶性银盐的沉淀反应。
![]()
以这类反应为基础的沉淀滴定法称为银量法,主要测定Cl-、Br-、I-、Ag+及SCN-等。
有一些沉淀如HgS、PbSO4、BaSO4 等也可用于沉淀滴定法,但重要性不及银量法。
银量法共分3 种,分别以创立者的姓名来命名。
1.莫尔法
在中性或弱碱性的含Cl-试液中,加入指示剂铬酸钾,用硝酸银标准溶液滴定,氯化银先沉淀,当砖红色的铬酸银沉淀生成时,表明Cl-已被定量沉淀,指示终点已经到达。此法方便、准确,应用很广。
2.福尔哈德法
(1)直接滴定法。在含 Ag+的酸性试液中,加 NH4Fe(SO4)2 为指示剂,以NH4SCN 为滴定剂,先生成AgSCN 白色沉淀,当红色的[Fe(SCN)2+]出现时,表示Ag+已被定量沉淀,终点已到达。此法主要用于测Ag+。
(2)返滴定法。在含卤素离子的酸性溶液中,先加入一定量的过量的AgNO3标准溶液,再加指示剂NH4Fe(SO4)2,以NH4SCN 标准溶液滴定过剩的Ag+,直到出现红色为止。两种试剂用量之差即为卤素离子的量。此法的优点是选择性高,不受弱酸根离子的干扰。但用本法测Cl-时,宜加入硝基苯,将沉淀包住,以免部分Cl-由沉淀转入溶液。
3.法扬斯法
在中性或弱碱性的含Cl-试液中加入吸附指示剂荧光黄,当用AgNO3 滴定时,在等当点以前,溶液中Cl-过剩,AgCl 沉淀的表面吸附Cl-而带负电,指示剂不变色。在等当点后,Ag+过剩,沉淀的表面吸附Ag+而带正电,它会吸附带负电的荧光黄离子,使沉淀表面显示粉红色,从而指示终点已到达。此法的优点是方便。
测定水中氯离子常用的是莫尔法,该方法测定氯离子的范围为5~100 mg/mL。水中氯离子含量是微量的,因此,用莫尔法准确测定自来水中的氯离子含量必须严格控制溶液的酸碱度和指示剂的用量。
安全提示
(1)AgNO3 试剂及其溶液具有腐蚀性,破坏皮肤组织,注意切勿接触皮肤及衣服。若不慎沾到皮肤及衣服,立即脱去污染的衣服,用肥皂水和清水彻底冲洗皮肤。若发生事故或感不适,立即就医。若眼睛接触,提起眼睑,用流动清水或生理盐水冲洗,并及时就医。不慎食入,用水漱口,给饮牛奶或蛋清,并及时就医。
(2)按照滴定规程规范操作。
任务一 硝酸银标准溶液的配制及标定
一、实训目的
(1)掌握AgNO3 标准溶液的配制和标定;
(2)深入理解银量法的原理;
(3)学会观察与判断荧光黄指示剂的滴定终点。
二、实训原理
AgNO3 标准滴定溶液可以用经过预处理的基准试剂AgNO3 直接配制。但非基准试剂AgNO3 中常含有杂质,如金属银、氧化银、游离硝酸、亚硝酸盐等,因此用间接法配制。先配成近似浓度的溶液后,用基准物质NaCl 标定。

三、实训用品及准备
1.实训仪器
表6-10 硝酸银标准溶液的配制及标定实训仪器

续表
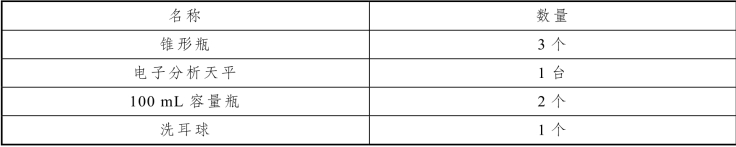
2.实训试剂
表6-11 硝酸银标准溶液的配制及标定实训试剂

(1)固体试剂NaCl:基准物质,在500~600 °C 灼烧至恒重。
(2)K2CrO4 指示液(50 g/L,即5%):称取5 g K2CrO4 溶于少量水中,滴加AgNO3溶液至红色不褪色,混匀。放置过夜后过滤,将滤液稀释至100 mL。
四、实训内容
1.配制 0.1 mol/L AgNO3溶液
称取1.7 g AgNO3溶于100 mL 不含Cl-的蒸馏水中,贮存于带玻璃塞的棕色容量瓶中,摇匀,置于暗处,待标定。
2.标定 AgNO3溶液
准确称取基准试剂NaCl 0.12~0.15 g,放于锥形瓶中,加50 mL 不含Cl-的蒸馏水溶解,加K2CrO4 指示液l mL,在充分摇动下,用配好的AgNO3 溶液滴定至溶液呈微红色即为终点。记录消耗AgNO3 标准滴定溶液的体积。平行测定3 次。以水代替NaCl 标准溶液做空白实验,
记录消耗AgNO3 标准滴定溶液的体积V0(mL)。
五、数据记录与处理
(1)数据记录
表6-12 AgNO3 标准溶液浓度的标定数据记录

(2)按下式计算AgNO3 标准溶液的浓度:
 (https://www.xing528.com)
(https://www.xing528.com)
式中 V—— 滴定NaCl 溶液消耗的AgNO3 标准溶液的体积,mL;
V0—— 滴定空白溶液消耗的AgNO3 标准溶液的体积,mL;
m—— 氯化钠的质量,g。
六、注意事项
(1)AgNO3 试剂及其溶液具有腐蚀性,破坏皮肤组织,注意切勿接触皮肤及衣服。
(2)配制AgNO3 标准溶液的蒸馏水应无Cl-,否则配成的AgNO3 溶液会出现白色浑浊,不能使用。
(3)实验完毕后,盛装AgNO3 溶液的滴定管应先用蒸馏水洗涤2~3 次后,再用自来水洗净,以免AgCl 沉淀残留于滴定管内壁。
任务二 水中氯离子含量测定
一、实训目的
(1)掌握用莫尔法进行沉淀滴定的原理和方法;
(2)学习滴定管等实验仪器的使用。
二、实训原理

由于滴定终点时,AgNO3 的实际用量比理论用量稍多,因此需要以蒸馏水做空白试验扣除。根据AgNO3 标准溶液的浓度和用量计算水样中Cl-的含量。
三、实训用品及准备
1.实训仪器
表6-13 水中氯离子含量测定实训仪器
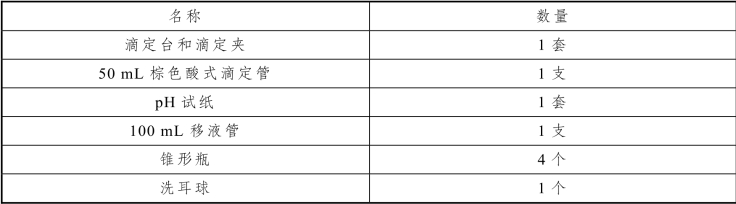
2.实训试剂
表6-14 水中氯离子含量测定实训试剂

K2CrO4 指示液(50 g/L,即5%):称取5 g K2CrO4 溶于少量水中,滴加AgNO3 溶液至红色不褪,混匀。放置过夜后过滤,将滤液稀释至100 mL。
四、实训内容
(1)用移液管准确移取 100.00 mL 自来水样置于干净的锥形瓶中,另取一锥形瓶用蒸馏水做空白试验。
(2)如果水样的pH 在6.5~10.5,可直接滴定。
(3)用移液管精确加入50 g/L 的K2CrO4 溶液1.00 mL,在不断摇动下,用标定好浓度的AgNO3 标准溶液滴定至溶液呈橙红色即为终点,记录消耗AgNO3 标准溶液的体积,计算氯离子含量。平行测定3 次。
五、数据记录与处理
1.数据记录
表6-15 水中氯离子含量的测定数据记录

2.计算公式
![]()
式中 V—— 自来水样消耗AgNO3 标准溶液的体积,mL;
V0—— 蒸馏水样消耗AgNO3 标准溶液的体积,mL;
V水样—— 自来水样的体积,mL;
ρ(Cl - )—— Cl-质量浓度,mg/L;
c(AgNO3)—— AgNO3 浓度,mol/L。
六、注意事项
(1)指示剂K2CrO4 的用量要合适
![]()

(2)滴定应控制溶液的pH

所以莫尔法只能在中性或弱碱性溶液中进行,即在pH=6.5~10.5 进行测定。
(3)干扰离子

七、实训评估
表6-16 水中氯离子含量的测定实训评估

八、拓展练习
(1)用K2CrO4 做指示剂时,其浓度太大或太小对测定有何影响?
(2)滴定过程中,为什么要充分摇动溶液?
(3)实验结束后,洗涤仪器是用自来水还是去离子水,为什么?
(4)莫尔法测定水中Cl-时,为什么在中性或弱碱性溶液中进行?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




