在酶促反应中,凡能使酶催化活性下降但不引起酶变性的物质称为酶的抑制剂(inhibitor)。抑制剂与酶活性中心内或活性中心外的必需基团相结合,抑制酶的催化活性。加热、加酸等理化因子使酶发生不可逆变性而失活,不属于抑制作用的范畴。抑制剂与酶结合紧密程度不同而产生的抑制作用不同。因此酶的抑制作用可分为两类:不可逆抑制(irreversible inhibition)和可逆性抑制(reversible inhibition)。一些抑制剂与酶的活性中心的必需基团以共价键结合,使酶失活,这种抑制剂不能用简单的透析、超滤等物理方法除去,这类抑制称为不可逆性抑制。一些抑制剂与酶和(或)酶底物复合物以非共价键结合,使酶活性降低或消失,用透析或超滤方法可将其除去,这类抑制是可逆性抑制。
(一)不可逆性抑制
1.羟基酶的不可逆性抑制剂 不可逆性抑制剂一般是非生物来源的,如有机磷农药敌百虫、敌敌畏及1059等。它们是羟基酶的不可逆性抑制剂,可与胆碱酯酶(choline esterase)活性中心的丝氨酸羟基结合生成磷酰化酶,使酶失活,胆碱酯酶的失活导致乙酰胆碱堆积,造成副交感神经兴奋,有机磷农药中毒时,患者可出现恶心、呕吐、多汗、肌肉震颤,瞳孔缩小,惊厥等症状。

临床上可用解磷定(pyridine aldoxime methyliodide,PAM)解除其抑制作用。

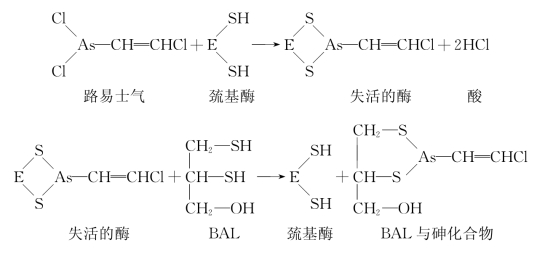
2.巯基酶的不可逆性抑制剂 另外有一些不可逆性抑制剂与酶分子的巯基结合,使酶失活,如低浓度的重金属离子(Hg2+、Ag2+、Pb2+等)及As3+等。路易士气(lewisite)是一种含砷化合物,能不可逆地抑制体内巯基酶的活性。
巯基酶的不可逆性抑制引起的中毒可用二巯基丙醇(British anti-lewisite,BAL)解除其毒性。
细菌细胞壁的主要组成成分是肽聚糖(黏肽)。青霉素可与细菌细胞壁的糖肽转肽酶活性中心的丝氨酸羟基共价键连接,形成稳定的无活性复合物,妨碍细菌细胞壁肽聚糖的合成而达到杀菌作用。因此青霉素的抑菌作用属于不可逆性抑制。
(二)可逆性抑制作用
可逆性抑制作用可分为竞争性抑制、非竞争性抑制、反竞争性抑制等。
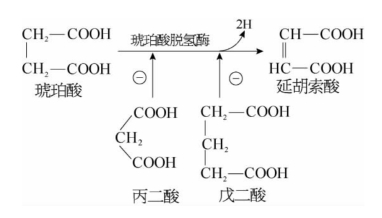
1.竞争性抑制作用 有些物质与酶的底物结构相似,可与底物可逆性竞争酶的活性中心,阻碍酶与底物结合而使酶的活性降低,这种抑制作用称为竞争性抑制作用(competitive inhibition)。由于抑制剂与底物结构相似,并与酶结合是可逆的,其抑制程度取决于底物及抑制剂的相对浓度和酶与它们的亲和力。如果在反应体系中增加底物浓度,可降低甚至解除抑制剂的抑制作用。例如,琥珀酸脱氢酶催化琥珀酸脱氢生成延胡索酸。如在该反应中加入与琥珀酸结构相似的丙二酸或戊二酸,则可使酶活性降低。而且,丙二酸或戊二酸与酶的亲和力明显大于琥珀酸与酶的亲和力。若增加反应体系中的琥珀酸浓度,此抑制作用可降低。
竞争性抑制的反应过程可用下式表示:

ki为抑制常数(即酶与抑制剂结合的解离常数),ki=k5/k4,EI为酶与抑制剂复合物。按米氏方程式的推导方法其倒数方程为:

有不同浓度抑制剂存在时,以1/V0对1/[S]作图(图3-17)可发现其动力学特点:①无论竞争性抑制剂浓度多少,各直线在纵轴截距都相同,即当[S]足够高时,竞争性抑制剂对酶的竞争作用可被抵消,V0仍可达到酶促反应的最大速率Vmax;②横轴截距表示的Km右移,说明有抑制剂时Km大于无抑制剂的Km,有抑制剂存在时的Km称为表观Km(不是酶的真正的Km)。竞争性抑制剂可使酶的表观Km增大。
临床应用的某些药物是根据竞争性抑制的原理设计的。例如,抗代谢药物与正常代谢物结构相似,可竞争性抑制某些酶的活性,阻碍代谢进行,达到治疗目的。磺胺类抗生素的抑菌作用即是典型的竞争性抑制作用(图3-18)。对磺胺类药敏感的细菌不能直接利用环境中的叶酸,但可在菌体内二氢叶酸合成酶(dihydrofolic acid synthetase,FH2合成酶)的作用下以对氨基苯甲酸(PABA)为底物合成二氢叶酸。二氢叶酸是核苷酸合成中辅酶四氢叶酸的前体。磺胺类药物的化学结构与对氨基苯甲酸相似,它是二氢叶酸合成酶的竞争性抑制剂,可抑制二氢叶酸的合成,进而达到抑菌作用。人类可直接利用食物中的叶酸,因此人体内核酸合成不受磺胺类药物的干扰。

图3-17 竞争性抑制作用的双倒数曲线(https://www.xing528.com)
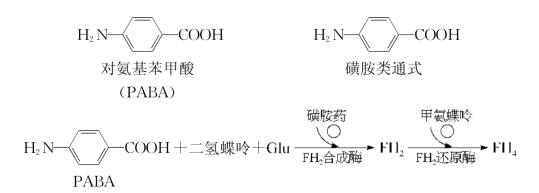
图3-18 磺胺类药物的抑菌作用
许多抗代谢药,如甲氨蝶呤(MTX)、5-氟尿嘧啶(5-FU)、6-巯基嘌呤(6-MP)等是酶的竞争性抑制剂,分别通过抑制四氢叶酸、脱氧胸苷酸、嘌呤核苷酸合成,起抗肿瘤作用。
2.非竞争性抑制作用 有些抑制剂不影响底物和酶结合,即抑制剂与酶活性中心外的必需基团结合,抑制剂既与E结合,也与ES结合,但生成的ESI复合物是终端复合物,不能释放出产物,这种抑制称为非竞争性抑制作用(non-competitive inhibition)。
非竞争性抑制的反应过程可用下式表示:

用米氏方程式推导,并得出其双倒数方程:


图3-19 非竞争性抑制作用的双倒数曲线
1/V0对1/[S]作图(图3-19)显示不同浓度非竞争性抑制作用的图形是一组具有不同斜率的直线,动力学特点如下:①随抑制剂浓度增加各直线在纵轴上的截距增加,说明该酶促反应的Vmax因抑制剂的存在而降低。②抑制程度与抑制剂浓度有关,增加底物浓度不能使抑制程度减少。③各直线交于横轴上同一位点,说明非竞争性抑制不改变酶对底物的亲和力,Km不变。
3.反竞争性抑制作用 此类抑制剂只与ES复合物结合生成ESI复合物,使中间产物ES量下降,终产物生成减少而导致酶促反应速率降低,这种的现象称为反竞争性抑制作用(uncompetitive inhibition)。当抑制剂与ES结合生成ESI后,使游离的酶浓度减少,因此最大反应速率Vmax必然降低。由于ES除了变成产物外,又有一个生成ESI复合物的去向,使E对S的亲和力升高,即Km变小。反竞争性抑制的反应过程可用下式表示:

反竞争性抑制的双倒数方程是:

以1/V0对1/[S]作图,不同抑制剂浓度的抑制曲线是多条平行线(图3-20)。即反竞争抑制剂可同时降低反应Vmax和表观Km。

图3-20 反竞争性抑制作用的双倒数曲线
现将三种可逆性抑制作用的特点总结于表3-6。
表3-6 酶的三种可逆性抑制作用的特点

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




