(一)反义核酸药物
反义核酸是指能与特定mRNA精确互补、特异阻断其翻译的寡核苷酸,包括反义RNA和反义DNA。反义核酸技术则是利用碱基互补原理,通过人工合成或生物体合成的特定DNA或RNA片段抑制或封闭靶基因,影响其转录与表达,或诱导核酶RNase H识别并切割mRNA,进而使其功能丧失的一种技术。这一技术的出现为新药的研发提供了新的手段。利用反义核酸技术研制的药物,被称为反义核酸药物,简称反义药物,目前包括反义DNA(antisense deoxyribonucleic acid,asDNA)、反义RNA(antisense ribonucleic acid,asRNA)、核酶、多肽核酸(peptidenucleic acid,PNA)等,具体定义如下。
反义DNA:能与DNA双链中的有义链互补结合的DNA片段。
反义RNA:能与mRNA互补配对的RNA片段。
核酶:具有酶催化功能的RNA分子,可特异性催化切割靶RNA从而达到抑制RNA功能的作用。核酶从结构上可分为锤头状核酶和发夹状核酶。
多肽核酸:以多肽骨架取代反义核酸的磷酸-核糖骨架后得到的一种DNA结构类似物,能与DNA或RNA单链通过碱基配对形成杂合双链分子。多肽核酸与DNA或RNA单键结合形成杂合双链的能力以及特异性相比于核酸分子大为提高。
1.反义核酸药物的作用机制 反义核酸药物降低基因表达的确切机制尚不完全清楚。目前普遍认为反义核酸药物主要通过碱基互补配对原则,与靶序列以碱基互补配对结合的方式,在复制、转录、表达三个水平发挥作用。目前已发现的反义核酸药物调控基因表达的机制有以下4种:①反义DNA在细胞核内以碱基互补配对形式与基因组DNA结合成三链核酸(triple helix nucleic acid)结构或与单链DNA结合成双链结构,阻止靶基因的复制与转录;②反义RNA与mRNA结合形成互补双链,阻断核糖体与mRNA的结合,抑制核糖体介导的mRNA翻译成蛋白质的进程;③反义核酸在细胞核内与mRNA结合后,可抑制mRNA的出核;④反义核酸与mRNA结合形成杂合双链分子,诱导RNase H降解RNA,从而缩短了mRNA的半衰期,减少目标蛋白质的翻译。
2.影响反义核酸药物发挥作用的关键因素 反义核酸药物对靶基因抑制作用的发挥,依赖于药物设计的3个关键因素。
(1)特异性:靶基因确定以后,通过分析其mRNA序列中的关键区段从而设计出相应的具有特异性的反义核酸序列。关键区段主要包括5'端帽结构区,mRNA的起始编码区或编码区,核前体mRNA的拼接区,逆转录病毒的引物区等。同时,为确保反义核酸序列的特异性,其最短序列应包含12~15个碱基。然而反义核酸也不是越长越好,一般其长度在15~30个碱基为宜。这是由于增加反义核酸序列的长度固然可以提高其与靶分子结合的特异性,但也增加了它与靶分子结合的难度,同时其进入细胞内的能力亦有所降低。
(2)稳定性:反义核酸的稳定性是影响药物作用效果的一个重要因素。未经修饰的寡核苷酸不论在体液内还是细胞中都极易被广泛存在的核酸酶降解,因而难以发挥作用。通过化学修饰法可以增强反义核酸的稳定性,抵抗核酸酶的降解作用。目前化学修饰主要分为碱基修饰和磷酸骨架修饰两类。
碱基是寡核苷酸与靶基因形成氢键直接接触的部位,氢键形成又是其发挥功能的必要条件。因此,碱基修饰应以不影响氢键形成为前提。最常使用的碱基修饰方法是在胞嘧啶的5'位点甲基化,除此以外,其他修饰基团还包括三氟甲基、炔丙基、咪唑丙基等。
磷酸骨架修饰:①磷原子的修饰:核酸上的磷原子是核酸酶攻击的中心,对该原子进行硫代、甲基化、胺化和酯化等处理,可显著抵抗核酸酶的降解作用。最常用的为硫代磷酸寡核苷酸,即用硫原子取代反义核酸骨架上的非桥连氧原子,以形成P—S键取代易被核酸酶攻击的P—O键,磷原子修饰后的反义核酸药物也被称为“第一代反义核酸药物”。②糖环修饰:糖环参与核酸骨架的形成,对其进行修饰可使核酸酶不能有效识别磷酸二酯键,其修饰方式主要包括形成α构型、1'位取代、2'位取代、3'-3'连接、5'-5'连接等。③构建嵌合体结构的反义核酸,即综合应用多种化学修饰手段,在硫代磷酸寡核苷酸基础上,将序列两翼或中间的核糖的2'位用其他基团修饰,成为嵌合型反义核酸,该反义核酸药物被称为“第二代反义核酸药物”。④磷酸二酯键修饰:核酸由磷酸二酯键连接而成,磷酸二酯键也是核酸酶作用的敏感位点。将核糖磷酸骨架置换成聚酰胺、吗啡啉、碳胺酯或肽骨架,可增加其稳定性,其中代表性的为多肽核酸,它是以中性的聚酰胺骨架代替核糖磷酸骨架的一种DNA结构类似物,可有效抵抗核酸酶和蛋白酶的降解作用,具备较高的生物利用度、稳定的理化性质及安全高效的特性,也被称为“第三代反义核酸药物”。
(3)水溶性和细胞膜通透性:反义核酸必须溶解于水且能透过细胞膜进入细胞内才能与mRNA发生作用。因此反义核酸需要在水溶性与脂溶性之间取得平衡。而反义核酸带负电荷且有较强的亲水性,因此不易与带同样电荷的靶细胞接触,更不易透过由脂质双分子层构成的细胞膜进入细胞内。化学修饰是解决这一问题的有效手段,例如通过引入亲脂性基团加强核酸亲脂性,可以有效地增强其透过细胞膜的能力。亲脂性基团通常通过磷酸酯键或羧酸酯键连接于末端的5'-OH或3'-OH上。最常用的亲脂性基团有脂肪酸(醇)、胆酸或胆固醇等。此外,改变反义核酸的负电荷(如将核酸与带有多价阳离子的多肽缩合制备成阳离子多肽-反义核酸复合物)也可以显著增强反义核酸药物透过细胞膜能力。
(二)siRNA药物
小干扰RNA(small interfering RNA,siRNA),也被称为短干扰RNA(short interfering RNA)或沉默RNA(silencing RNA),是一段长为20~25对核苷酸的双链RNA(dsRNA)分子,在生物学上有许多不同的用途。目前已知siRNA主要参与RNAi过程,以带有专一性的方式调节基因的表达,在生理和病理过程中发挥重要作用。RNAi技术是针对传染性疾病及恶性肿瘤的基因治疗领域的重要工具。
1.siRNA的作用机制 目前已经清楚siRNA实现靶基因的表达沉默主要是通过抑制mRNA的翻译过程,因此也被称为转录后基因沉默。内源或外源dsRNA首先在各种蛋白质、酶的作用下介导细胞内靶mRNA发生特异性降解,形成许多小片段RNA,即siRNA。siRNA通过与mRNA中的同源序列互补结合,进一步切割其他靶mRNA并产生更多siRNA,从而产生级联放大效应,最终导致靶基因的表达沉默。
siRNA介导的RNAi包括三个阶段,即起始阶段、效应阶段以及倍增阶段(图4-1)。
在起始阶段,外源长dsRNA可由RNA病毒感染、转座子转录等多种方式进入细胞内。进入细胞后,dsRNA首先与蛋白质复合体Dicer酶结合。Dicer酶是RNaseⅢ家族成员,可以特异性识别dsRNA,以一种ATP依赖性的方式把外源dsRNA剪切降解为21~23对核苷酸的短dsRNA,即siRNA。
在RNAi效应阶段,siRNA与含Argonauto(Ago)蛋白的核酶复合物结合,形成RNA诱导沉默复合物(RNA-induced silencing complex,RISC)并被激活。激活后的RISC可将siRNA解链成单链,其中一条单链被清除,另一条单链与RISC结合形成识别靶mRNA分子的探针;在Ago内切酶的催化作用下,反义RNA单链寻找并结合与其互补的mRNA,然后RISC在距离siRNA 3'端12个碱基的位置将mRNA剪切降解,阻止mRNA的进一步翻译。
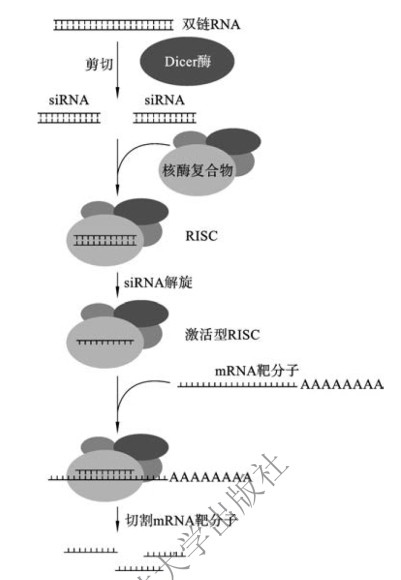
图4-1 siRNA介导的基因沉默作用机制(https://www.xing528.com)
在倍增阶段,以mRNA为模板,RISC中的RNA依赖性RNA聚合酶催化扩增产生新的dsRNA,并在Dicer酶作用下产生更多的siRNA,并与RISC结合进一步降解mRNA,从而产生级联放大效应。在这种作用方式下,少量的siRNA即可在短时间内产生高效的基因沉默效果。
2.siRNA的设计 在确定靶基因之后设计siRNA靶位点时,应选择对靶mRNA特异而与其他内源基因无同源性的核苷酸序列。同时siRNA的设计还需要注意以下4点原则。
(1)靶基因作用部位:设计位点时须避开cDNA的5'及3'端的非翻译区(untranslated region,UTR),原因是这些地方有丰富的调控蛋白结合区域,而这些UTR结合蛋白或者翻译起始复合物可能会影响小干扰核酸内切酶复合物(siRNP)与mRNA的结合进而影响RNAi的效果。一般来说位于cDNA的起始转录位置下游50~100 bp处较为合适。
(2)siRNA分子的长度:目前认为21~23个核苷酸是siRNA的合适长度,其中至少20个核苷酸同mRNA准确配对,且siRNA在3'端具有两个TT的结构有最佳沉默效果。
(3)siRNA分子的GC含量:一般认为GC含量在50%左右较好,也有文献报道siRNA的GC含量在32%~79%范围内均具有很好的干扰效果。
(4)将设计的siRNA序列在BLAST网站(www.ncbi.nlm.nih.gov/BLAST/)上进行比较,排除能与非目标基因mRNA配对的序列。
根据上述原则选出合适的目标序列进行合成。通常一个基因需要设计3~4个与靶序列不同区域配对的siRNAs,并在细胞和动物水平上进行验证。
3.siRNA的修饰 由于RNA在体内容易被RNA酶降解,因此增强siRNA的体内稳定性成为其应用于临床的关键。其中化学修饰是提高siRNA稳定性,保证其体内基因沉默效果的有效手段之一。与反义核酸类似,目前对siRNA的化学修饰包括核糖修饰、磷酸骨架修饰和碱基修饰等。
(三)miRNA药物
miRNA是一类由内源基因转录的非编码单链RNA分子,它们在动植物中参与转录后基因表达调控。成熟的miRNA约含有22个核苷酸,通过与目标mRNA形成完全配对或不完全配对抑制其翻译。目前在动植物及病毒中已发现超过30000个miRNA分子。不同物种之间miRNA分子在序列上呈现出高度的同源性,提示其功能在整个生命活动中发挥着重要作用。
1.miRNA的作用机制 与siRNA作用类似,miRNA也是通过与靶分子mRNA结合从而抑制翻译过程或者降解靶分子mRNA从而达到基因沉默效果(图4-2)。miRNA基因通常由RNA聚合酶Ⅱ(pol Ⅱ)转录成长度为100~1000个核苷酸的初级转录物(pri-miRNA)。pri-miRNA在RNase Ⅲ及其辅助因子的作用下被剪切成长度大约70个核苷酸具有茎环结构的miRNA前体(pre-miRNA)。pre-miRNA从核内转运到细胞质中,在Dicer酶的作用下被剪切成21~25个核苷酸长度的成熟miRNA双链。这种双链很快被引导进入RISC中,其中一条链被降解,另一条成熟的单链miRNA保留在这一复合物中,通过与相应mRNA位点的结合,调控靶基因表达。目前已发现miRNA调控基因表达的方式有3种。

图4-2 miRNA介导的基因沉默作用机制
(1)以线虫lin-4为代表:作用时与靶标mRNA不完全互补结合,进而阻遏翻译过程而不影响mRNA的稳定性。该抑制效果具有瞬时性和可逆性,可以在特定的情况下再次开启蛋白质翻译。这种具有调控基因翻译作用的miRNA是目前发现最多的一种类型。
(2)以拟南芥miR-171为代表:作用时与靶标mRNA完全互补结合,作用方式和功能与siRNA非常类似,最后切割降解靶mRNA。因此这种基因沉默过程是不可逆的。
(3)以let-7为代表:它具有以上两种作用模式,当与靶标mRNA完全互补结合时,直接切割降解mRNA;当与靶标mRNA不完全互补结合时,仅仅抑制其翻译过程而不切割降解mRNA。
2.miRNA药物的种类 越来越多的研究显示miRNA在肿瘤、糖尿病、心血管疾病等多种疾病的发生和发展中发挥着重要的作用。据此而研发新的miRNA药物(如导入外源miRNA模拟物从而抑制靶基因的表达,或抑制内源miRNA的基因沉默作用从而促进靶基因的翻译)成为核酸类药物研究的重要组成部分。目前针对miRNA的药物包括miRNA模拟物、miRNA的反义寡核苷酸(anti-miRNA oligonucleotide,AMO)、miRNA海绵(miRNA sponge)以及miRNA屏障(miRNA masking)等。
(1)miRNA替代治疗主要通过导入人工合成的外源miRNA模拟物以达到治疗疾病的目的。有研究显示导入外源双链miRNA模拟物沉默目的基因的效果较单链miRNA模拟物的效果提高了100~1000倍。
(2)miRNA的反义寡核苷酸(AMO)是目前最常用的miRNA药物。将人工合成的反义寡核苷酸导入细胞内,与内源miRNA特异性结合形成异源双链,抑制miRNA对靶基因的沉默作用,实现对基因功能的调控。
(3)miRNA海绵(miRNA sponge)技术是2007年由麻省理工学院的Phillip Sharp开发出的一种长期抑制miRNA基因的高效方法。miRNA海绵是一条mRNA,其3'-UTR包含若干个miRNA靶定位点。更重要的是,这些靶定位点与RISC切割位点有一些错配。这样,miRNA海绵就不会被降解而与RISC稳定结合,让它远离天然的mRNA靶点。miRNA海绵目前只用于体外试验。
(4)miRNA屏障(miRNA masking)是与靶分子mRNA的3'-UTR上RISC结合位点互补的特异性寡核苷酸,与靶mRNA形成局部双链以阻止AMO的结合。因此miRNA屏障具有较好的特异性,同时避免了AMO可能导致mRNA降解的不良反应。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




